
| A. | Ca2+ | B. | OH- | C. | Ba2+ | D. | NH${\;}_{4}^{+}$ |
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
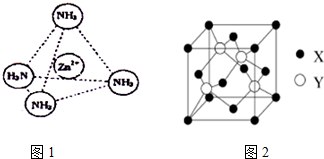
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第14列元素形成化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 第17、18列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是2 | B. | 质量数是1 | C. | 电子数是3 | D. | 中子数是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可长期存放碱性食物 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 过氧化钠用作呼吸面具中的供氧剂 | D. | 氯气用于农药的生产和药物合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)<r(Y)<r(W) | |
| C. | W的简单氢化物的热稳定性比Z的强 | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
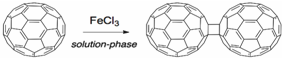

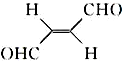 ,下列叙述正确的有AD.
,下列叙述正确的有AD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷,丙烯 | B. | 乙烷,乙烯 | C. | 甲烷,乙烯 | D. | 乙烷,丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com