
| A、正反应速率加大,逆反应速率变小,平衡正向移动 |
| B、正反应速率变小,逆反应速率加大,平衡逆向移动 |
| C、正反应速率和逆反应速率都变小,平衡正向移动 |
| D、正反应速率和逆反应速率都变小,平衡逆向移动 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
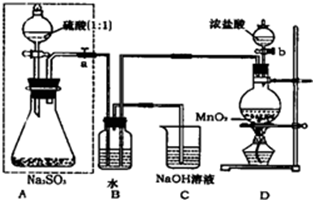
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平均相对分子质量增大 |
| B、NO2的转化率提高 |
| C、压强为原来的2倍 |
| D、颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、催化剂可以缩短可逆反应达到平衡的时间,但是不能改变化学平衡状态 |
| B、如果改变影响平衡的一个条件,平衡就会朝着减弱这种改变的方向移动 |
| C、对于合成氨工业,在合成氨的反应中,温度越高,越有利于氨的合成 |
| D、化学平衡常数、平衡转化率均可用于说明化学反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、水电离出的c(H+)=10-12mol?L-1的溶液中:Ca2+、K+、Cl、HCO3- | ||
C、
| ||
| D、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(△H2-△H3):(△H1-△H3) |
| B、(△H3-△H2):(△H1-△H3) |
| C、(△H3-△H2):(△H3-△H1) |
| D、(△H1-△H2):(△H3-△H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com