
��15�֣�̼���仯�����й㷺����;��
��1���ڵ绯ѧ�У�����̼���缫���ڼ���п�̸ɵ���У�̼���� ����
��2����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��C��s��+H2O��g��=CO��g��+H2��g������H=+131.3kJ?mol-1����Ҫ�Ʊ���״����22.4��ˮú����ת�Ƶĵ��ӵ����ʵ���Ϊ ����Ҫ���յ�����Ϊ kJ��
(3����ҵ�ϰ�ˮú���еĻ�����徭��������õĽϴ�H2���ںϳɰ���
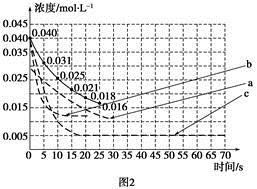
N2��g����3H2��g�� 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��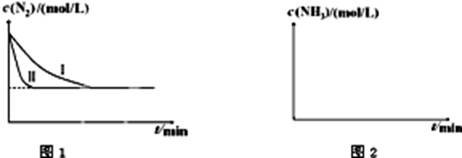
����ʵ���Ƚϣ�ʵ���ı������Ϊ�� ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��4��Na2CO3���ڽ������������ŷ�������CO2�IJ�����1L0.2mol/L Na2CO3��Һ���ձ�״����2.24LCO2����Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(8��) CO2������Ҫ��������,��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�����ش����塣
��1����ѧ����H2��CO2�����״�ȼ�ϡ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3��25 mol H2����һ�������·�Ӧ�����CO2��CH3OH(g)��H2O(g)�����ʵ���(n)��ʱ��ı仯��ϵ��ͼ��ʾ��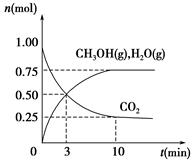
��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________ ����ӷ�Ӧ��ʼ��3 minʱ��������ƽ����Ӧ����v(H2)��____________________��
�����д�ʩ��һ����ʹCO2��ת�����������___________________ ��
A ��ԭ�������ٳ���1 mol H2 B ��ԭ�������ٳ���1 mol CO2
C ��С�������ݻ� D ʹ�ø���Ч�Ĵ���
E����ԭ�����г���1 mol He F����ˮ��������ϵ�з����
��2����ѧ�һ�����������һ���������������̼��Ӧ�����Ҵ�ȼ�ϣ����Ȼ�ѧ��Ӧ����ʽΪ:2CO2(g)��6H2(g)  CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
��3����һ��ѹǿ�£���ø÷�Ӧ��ʵ�����������ʾ������ݱ������ݻش��������⡣
 �¶�(K) �¶�(K) CO2ת����/(%) CO2ת����/(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1��5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 ��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)��
��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼ�ش��������⣺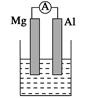
��1)���ձ�����ҺΪϡ���ᣬ��۲쵽��������______________________
������ӦʽΪ��_________________________________________________��
��2�����ձ�����ҺΪ����������Һ����Ϊ________(��Mg��Al)���ܷ�Ӧ��ѧ����ʽΪ
______________________________________________________________��
����Al��Cu��Ũ�������ԭ��أ��������ĵ缫��ӦʽΪ
��1���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״��� CO(g)��2H2(g)  CH3OH(g)��
CH3OH(g)��
�����÷�Ӧ���ش��������⣺���и����У����ܹ�˵���÷�Ӧ�Ѵﵽƽ�����________(�����)��
a�����¡����������£���������ƽ����Է�����������
b��һ�������£�CH3OH�ֽ�����ʺ�CH3OH���ɵ��������
c��һ�������£�CO��H2��CH3OH��Ũ�ȱ��ֲ���
d��һ�������£���λʱ��������2 mol H2��ͬʱ����1 mol CH3OH
��2��2009��10�£��й���ѧԺ����Ӧ�û�ѧ�о����ڼ״�ȼ�ϵ�ؼ�����������ͻ�ƣ���װ�����Ժ�����ؼ�����ʽ��ѡ��״�ȼ�ϵ�صĹ���ԭ������ͼ��ʾ��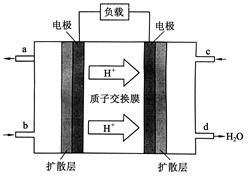
�ٸõ�ع���ʱ��b��ͨ�������Ϊ________________��
c��ͨ�������Ϊ________________��
�ڸõ�ظ����ĵ缫��ӦʽΪ��_______
�۹���һ��ʱ���6.4 g�״���ȫ��Ӧ����CO2ʱ��
��______________NA������ת�ơ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�
��֪CO(g)+H2O(g) CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 ��H��+8.0kJ��mol��1
��H��+8.0kJ��mol��1 ��H��+90.4kJ��mol��1
��H��+90.4kJ��mol��1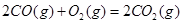 ��H��-556.0kJ��mol��1
��H��-556.0kJ��mol��1 ��H��-483.6kJ��mol��1
��H��-483.6kJ��mol��1 ��
�� ��Ӧ����
��Ӧ���� �Ȼ�ѧ����ʽ ��
�Ȼ�ѧ����ʽ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣���2012?���죩����[CO��NH2��2]�����������˹��ϳɵ��л��
��1����ҵ��������CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ��
��2������̼�� =4ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
=4ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
��A����淴Ӧ����v����CO2�� B�������Ӧ����v����CO2��������ڡ���С�ڡ����ڡ�����
��NH3��ƽ��ת����Ϊ ��
��3���˹�����ɲ��ü�ӵ绯ѧ������ȥ��л�����е����أ�ԭ����ͼ2��ʾ��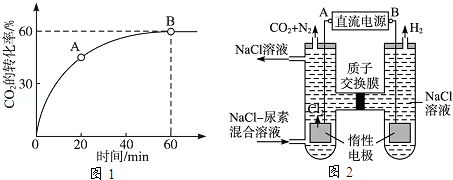
�ٵ�Դ�ĸ���Ϊ ���A����B������
���������з����ķ�Ӧ����Ϊ �� ��
�۵���������������Һ��pH����ǰ��Ƚ� �����������ռ�������13.44L����״���������ȥ������Ϊ g������������ܽ⣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��12�֣������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�
2NO��2CO 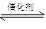 2CO2��N2
2CO2��N2
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�����±���
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol��L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c(CO)/ mol��L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
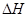 0�����>������<������=������
0����д��>������<������=������| ʵ���� | T/�� | NO��ʼŨ�� mol��L-1 | CO��ʼŨ�� mol��L-1 | �����ıȱ���� �O��g-1 |
| �� | 280 | 1.2��10-3 | 5.8��10-3 | 82 |
| �� | | | 5.8��10-3 | 124 |
| �� | 350 | 1.2��10-3 | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��8�֣�ij�¶�ʱ,��һ��2 L���ܱ�������,X��Y��Z�����������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ������,����д���пհף�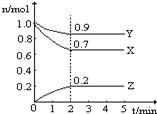
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ______ __ ��
��2���÷�Ӧ���� ��ʼ�ġ���������Ӧ ���淴Ӧ �����淴Ӧͬʱ����
��3���÷�Ӧ�� ______ ���ӵ���ƽ��״̬��
��4����Ӧ��ʼ��3 min,����X��ƽ����Ӧ����Ϊ _______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣���֪CO2��SO2��NOx�ǶԻ���Ӱ��ϴ�����壬����������ѧ֪ʶ���뻷��������ʹ������Χ�Ŀ������á�
��1�����������У�SO2����������SO3����Ӧ�����ϵ
��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ��������
���Ϊƽ��״̬������ͼ��֪��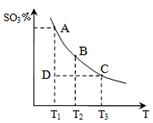
��2SO2(g) + O2(g) 2SO3(g)�ġ�H____0(�>����<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ����ƶ�������
2SO3(g)�ġ�H____0(�>����<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ����ƶ�������
�����¶�ΪT1ʱ����Ӧ���е�״̬Dʱ��v(��)_______v(��)���>������<����=������
�����᳧��SO2β���ù����İ�ˮ���գ���SO2�ɽ��л��ռ��������ã���Ӧ�Ļ�ѧ����ʽΪ �� ��
�����Ͱ��������������Dz��ð�ˮ���������е�SO2������һ�������������������ղ��ﷴӦ�����ŵ�����ܻ�������SO2�⣬���ܵõ�һ�ָ��Ϸ��ϣ��ø��Ϸ��Ͽ��ܵĻ�ѧʽΪ��________(ֻҪ��дһ��)��
��2������β��(�������ࡢCO��NOx������)�dz��п�������ȾԴ�������ķ���֮һ������������������װһ������ת������(�ò����ٺϽ�������)����ǰ�벿��Ӧ����ʽΪ��
2CO��2NO  2CO2��N2�������ŵ��� ��
2CO2��N2�������ŵ��� ��
��3������������ͼ��ʾװ�ã����õ绯ѧԭ����CO2��SO2ת
��Ϊ��Ҫ����ԭ�ϡ�
����AΪCO2��BΪH2��CΪCH3OH���������缫��ӦʽΪ
��
����AΪSO2��BΪO2��CΪH2SO4��������Աϣ��ÿ����
��C�����100 mL 10 mol/L H2SO4����A��ͨ������(SO2
���������Ϊ1%)������Ϊ L/min(��״��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪CO2(g)��3H2(g) CH3OH(l)��H2O(l)����H����130.9 kJ��mol��1
CH3OH(l)��H2O(l)����H����130.9 kJ��mol��1
(1)�ֽ�0.8 mol CO2��2.4 mol H2�����ݻ�Ϊ20 L���ܱ������з���������Ӧ������˵����ȷ����__________(����ĸ���)��
| A���÷�Ӧ�ڵ��������Է����� |
| B����������CO2������������㶨ʱ���÷�Ӧ�Ѵ�ƽ��״̬ |
| C���������������䣬ʵ����ƽ�ⳣ����K(T1)��K(T2)����T1��T2 |
| D�����и÷�Ӧ��X��Y���ִ�����X��ʹ����Ӧ���ʼӿ�Լ5��105����Y��ʹ�淴Ӧ���ʼӿ�Լ8��106��(����������ͬ)������������Ӧ��ѡ��XΪ���������� |

| ʵ�� ��� | CO2��ʼ Ũ��/mol��L��1 | ��Ӧ�� ��/�� | ��Ӧѹ ǿ/kPa | �Ƿ���� ���� |
| A | 0.030 | 150 | 101 | �� |
| B | 0.040 | 150 | 101 | �� |
| C | 0.040 | 250 | 101 | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com