
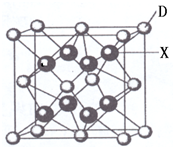
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E,A、B、C是同一周期的非金属元素,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,B、C为N、O、F中2种,化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层,则D为Ca、C为O,可推知B为N元素,AC2为非极性分子,则A为碳元素;E的原子序数为26,则E为Fe元素.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E,A、B、C是同一周期的非金属元素,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,B、C为N、O、F中2种,化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层,则D为Ca、C为O,可推知B为N元素,AC2为非极性分子,则A为碳元素;E的原子序数为26,则E为Fe元素.
(1)E为Fe元素,在周期表中的位置:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)A为碳元素、B为氮元素、C为氧元素,同周期自左而右第一电离能增大,氮元素原子2p能级有3个电子,处于半满稳定状态,电子能量低,氮元素第一电离能高于相邻的元素的,所以第一电离能由小到大的顺序为C<O<N,
故答案为:C<O<N;
(2)B为氮元素,其氢化物为NH3,分子中含有3个N-H键,N原子有1对孤对电子对,空间构型为三角锥形,CO 3 2-的C原子孤电子对数=$\frac{4+2-2×3}{2}$=0,价层电子对数=3+0=3,故碳原子采取sp2杂化,
故答案为:三角锥形;sp2;
(3)化合物AC2是CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ;一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O.
;一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O.
故答案为: ;N2O.
;N2O.
(4)任意一种由两种元素组成的与CaO2中的阴离子互为等电子体的微粒的化学式:F2等,
故答案为:F2;
(5)A、B两元素按原子个数比1:1形成的带一个单位负电荷的阴离子为CN-,Fe的高价态离子和低价态离子均能与CN-组成六配位的配离子,该配离子的化学式[Fe(CN) 6]3-或[Fe(CN) 6]4-,
故答案为:[Fe(CN) 6]3-或[Fe(CN) 6]4-;
(6)X是周期表中电负性最大的元素,则X为F元素,该元素与Ca元素组成的离子化合物,晶胞中氟离子数目为8,钙离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶体的化学式为:CaF 2,
故答案为:CaF 2.
点评 本题是对位置结构与性质的考查,涉及结构性质越位置关系、元素周期律、电子式与核外电子排布、配合物与杂化理论、分子结构、晶胞计算等,难度中等,是物质结构的综合性题目,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO3-、Cl- | |
| C. | pH=7的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①③⑥ | C. | ②③④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.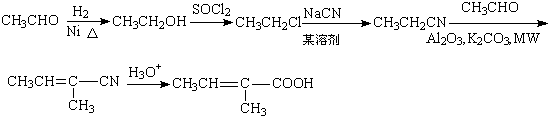 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
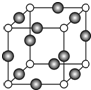 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com