
分析 在反应3S+6KOH=2K2S+K2SO3+3H2O中,只有S元素的化合价发生变化,S→K2S,化合价降低,被还原,S→K2SO3,化合价升高,被氧化,根据氧化剂与还原剂得失电子数目相等计算.
解答 解:在反应3S+6KOH=2K2S+K2SO3+3H2O中,只有S元素的化合价发生变化,氧化剂和氧化剂都是S,
反应中S→K2S,S化合价降低,则S被还原,S为氧化剂,
S→K2SO3,S化合价升高,则S被氧化,S为还原剂,
由生成物可知,被还原与被氧化的S的物质的量之比为2:1,
则质量之比也为2:1,当参加反应的3mol的硫转移电子的物质的量为4mol,所以当有0.3mol的S参加反应时,反应中转移的电子为0.4mol,
故答案为:2:1;0.4.
点评 本题考查氧化还原反应的计算,题目难度不大,注意根据化合价的变化判断氧化产物和还原产物,可根据化学计量数直接判断出被还原的硫与被氧化的硫的质量比为.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
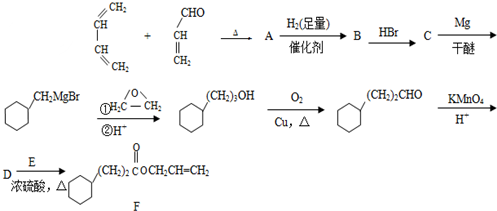

 ,A中所含官能团的名称是醛基、碳碳双键;
,A中所含官能团的名称是醛基、碳碳双键; ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
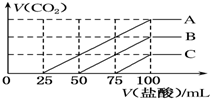 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2 mol•L-1 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分为NaOH和 Na2CO3,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.| 物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 90%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸的摩尔质量是63 g | |
| B. | 1 mol CO的质量是28 g | |
| C. | 4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量N2和CO2中,共用电子对的个数比为3:4 | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 | |
| D. | 当x=2时,每生成1mol N2,转移电子数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com