
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e﹣=4OH﹣
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.该电池反应2.24 L H2(标准状况)时,有0.1 mol电子转移
【答案】D
【解析】解:A.该燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e﹣=4OH﹣ , 故A正确;
B.该电池反应式为2H2+O2=2H2O,电解质溶液中氢氧化钾不参加反应,所以电解质溶液中KOH的物质的量不变,故B正确;
C.碱性溶液中负极反应为2H2﹣4e﹣+4OH﹣=2H2O,正极反应为O2﹣4e﹣+2H2O=4OH﹣ , 将两式相加即得电池反应式,所以电池反应式为2H2+O2=2H2O,故C正确;
D.电池反应2.24 L H2(标准状况)时,氢气的物质的量= ![]() =0.1mol,转移电子的物质的量为0.1mol×2=0.2 mol,故D错误;
=0.1mol,转移电子的物质的量为0.1mol×2=0.2 mol,故D错误;
故选D.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 他因此获得了1918年诺贝尔化学奖. 在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的转化率比是 .
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,
密度 . (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
(1)分别写出氢元素三种同位素的名称:______、_______、______。写出用做制造氢弹原料的同位素原子:______(填原子符号)。
(2)互为同位素的是________(填编号,下同)。
(3)互为同素异形体的是_______。
(4)由①和④中微粒能结合成三原子化合物,写出这些化合物的相对分子质量的最大值和最小值是_____________。
(5)质量相同的H216O 和D216O 所含质子数之比为_______,中子数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取4 g Na2O2样品与过量水反应,待完全反应后,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测反应中可能生成了H2O2,并进行实验探究。
⑴试设计实验证明溶液X中含过氧化氢_________________。
⑵通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加几滴酚酞试液,实验现象为___________。
⑶取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则该反应的离子方程式为___________。
⑷已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:____
![]() ________MnO4-+ ________H2O2 + ________H+ — ________Mn2+ + ________O2↑ + __________。
________MnO4-+ ________H2O2 + ________H+ — ________Mn2+ + ________O2↑ + __________。
取100 mL 溶液X,使其与过量酸性KMnO4溶液反应,最终生成224 mL O2(已折算为标准状况),则此样品中Na2O2的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是( ) 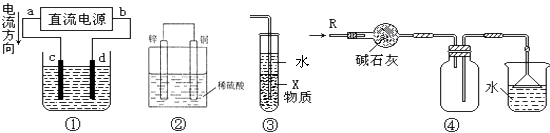
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40s内用N2O4表示的平均反应速率为molL﹣1s﹣1 .
(2)计算在80℃时该反应的平衡常数K= .
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填字母).
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
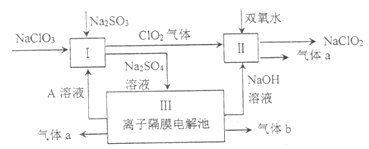
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
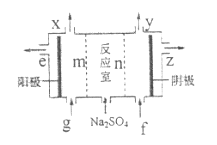
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,E,F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( ) 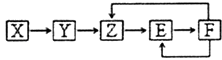
A.X可能是一种氢化物
B.X生成Z一定是化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com