
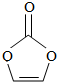
| A. | 分子式为C3H2O3 | B. | 分子中只含有极性键 | ||
| C. | 分子中含6个σ键 | D. | 各碳原子杂化的方式不同 |
分析 A.根据结构简式确定分子式;
B.同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键;
C.双键中含有一个σ键、一个π键,单键都是σ键;
D.该分子C-O中C原子价层电子对个数是4且不含孤电子对、C=O中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式.
解答 解:A.根据结构简式确定分子式为C3H2O3,故A正确;
B.同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键,所以C-之间存在非极性键、C-H和C-O原子之间存在极性键,故B错误;
C.双键中含有一个σ键、一个π键,单键都是σ键,所以该分子中含有8个σ键,故C错误;
D.该分子C-O中C原子价层电子对个数是4且不含孤电子对,C原子为sp3杂化;C=O中C原子价层电子对个数是3且不含孤电子对,C原子杂化方式为sp2,故D错误.
故选A.
点评 本题考查物质结构,为高频考点,涉及原子杂化方式判断、化学键判断、分子式确定等知识点,侧重考查学生分析判断能力,难点是判断C原子杂化类型,题目难度不大.


科目:高中化学 来源: 题型:选择题
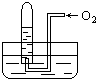 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
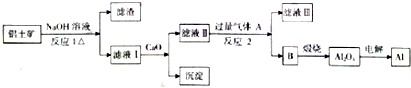
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
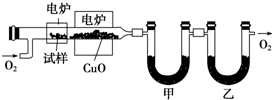
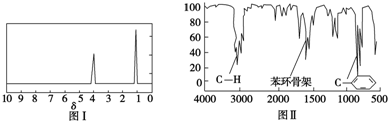
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 在 CuSO4溶液中加入一小块Na | Na溶解,生成沉淀 | 有Cu产生 |
| B | 将浓氨水滴加至烧瓶中的CaO上 | 产生的气体可使湿润的红色石蕊试纸变蓝 | 有氨气生成 |
| C | 在Fe(NO3)2溶液中加入稀H2SO4 | 溶液变为黄色 | 稀H2SO4具有氧化性 |
| D | 将氨气通入I2-淀粉溶液中 | 溶液蓝色褪去 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
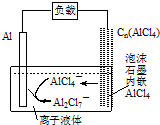
| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com