
 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.分析 Ⅰ.Li-Al/FeS电池是一种二次电池,原电池工作时,较为活泼的单质锂作负极,正负极反应相加可得反应的电池总反应;
Ⅱ.(1)根据Ksp的意义,越是Ksp小的物质越容易生成,注意不能引进杂质离子,据此回答;
(2)A.同素异形体是同种元素组成的单质;
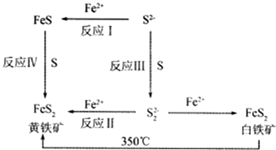
B.黄铁矿和白铁矿的分子式是一样的性质有差别;
C.黄铁矿是白铁矿加热下的产物.
(3)S22-在酸性环境下可以发生自身氧化还原反应;
(4)①金属锂可以和水之间反应生成氢氧化锂和氢气;
②根据信息:第一次放电行为的反应是温度低时,锂与FeS2反应只生成A物质;第二次放电行为的反应是:温度升高,锂与A继续反应(产物之一为Fe),据此回答;
(5)FeS为阳极,Al为阴极,阳极上会发生失电子的氧化反应,据此书写电极反应.
解答 解:Ⅰ.该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe;负极的电极反应式为:Li-e-═Li+.正负极反应相加可得反应的电池总反应为2Li+FeS═Li2S+Fe,故答案为:2Li+FeS═Li2S+Fe;
Ⅱ.(1)越是Ksp小的物质越容易生成,CuS、H2S都和氯化亚铁之间不反应,硫化铵可以和氯化亚铁之间反应得到硫化亚铁沉淀,但是硫化钠的溶液碱性较强,不可避免的会产生氢氧化亚铁杂质,所以A更适宜.
故选A;
(2)A.同素异形体是同种元素组成的单质,但是黄铁矿和白铁矿是化合物,故A错误;
B.黄铁矿和白铁矿的分子式是一样的,因为晶体结构不同而导致性质有差别,故B正确;
C.黄铁矿是白铁矿加热下的产物,由此可见黄铁矿比白铁矿更稳定,故C正确;
故选A;
(3)S22-在酸性环境下可以发生自身氧化还原反应,即S22-+2H+=S↓+H2S↑,故答案为:S22-+2H+=S↓+H2S↑;
(4)①金属锂可以和水之间反应生成氢氧化锂和氢气;
②根据信息:第一次放电行为的反应是温度低时,锂与FeS2反应只生成A物质,即2Li+FeS2=Li2FeS2,第二次放电行为的反应是:温度升高,锂与A继续反应(产物之一为Fe),发生的反应为:2Li+Li2FeS2=2Li2S+Fe,故答案为:2Li+FeS2=Li2FeS2;2Li+Li2FeS2=2Li2S+Fe;
(5)FeS为阳极,Al为阴极,阳极上会发生失电子的氧化反应,发生的电极反应为:2FeS-2e-=FeS2+Fe2+,故答案为:2FeS-2e-=FeS2+Fe2+.
点评 本题综合考查学生元素以及化合物的性质、电化学反应原理等基本知识,属于综合知识的考查,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl3+2H2O
+3FeCl3+2H2O +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. |  制备氢气并检验H2的可燃性 | |
| D. | 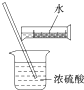 配制硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com