
将少量SO2通入Fe2(SO4)3溶液中发生反应:SO2+2Fe3++2H2O = SO42-+2Fe2++4H+;然后再加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O。下列判断正确的是
A.还原性Cr3+> Fe2+> SO2 B.氧化性Cr2O72-> SO2> Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O72-能将SO2氧化成SO42-
科目:高中化学 来源: 题型:

| ||
| ||
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 蓝 色 |
Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl 5Cl2+I2+6H2O=2HIO3+10HCl (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
| B | 取某溶液少量,加入盐酸酸化的BaCl2溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 将SO2通入溴水中 | 验证SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
类推思维是化学解题中常用一种思维方法,下列关于离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入到CuSO4溶液中:Fe+Cu2+====Fe2++Cu | 将Na加入到CuSO4溶液中:2Na+Cu2+====2Na++Cu |
| B | 少量CO2通入Ca(ClO)2溶液中:Ca2++2ClO-+CO2+H2O====CaCO3↓+2HClO | 少量SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO |
| C | 少量CO2通入澄清石灰水中:Ca2++2OH-+CO2====CaCO3↓+H2O | 少量CO2通入Ca(NO3)2溶液中:Ca2++2OH-+CO2====CaCO3↓+H2O |
| D | 稀硫酸与Ba(OH)2溶液反应至中性:Ba2++2OH-+2H++ | NaHSO4溶液与Ba(OH)2溶液反应至中性:Ba2++2OH-+2H++ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省焦作市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2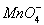 +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+
C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com