
【题目】结合所学相关知识,完成以下实验题。
Ⅰ.实验室中盐酸的用途十分广泛,常常用来制备气体
(1)某小组同学欲用4mol/L的盐酸配制230mL0.4mol/L盐酸溶液,需用量筒取用4mol/L盐酸_____mL,实验中需要用到的玻璃仪器有_____、_____、量筒、烧杯、玻璃棒。
(2)下列实验操作使配制的溶液浓度偏低的是_____。
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
Ⅱ.已知铁屑和氯气在500~600℃下可制取无水FeCl3,如图是制取氯化铁粉末所需的装置,已知氯化铁粉末容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。请回答下列问题。

(1)按照气体流向从左到右的顺序连接仪器(填仪器接口):①接____,____接____,____接②。
(2)A装置的烧瓶中发生反应的离子方程式为_____,B装置中发生反应的化学方程式为____。
(3)D装置的作用是_____;E装置的作用是_____。
(4)实验开始时,应先点燃_____(填“A”或“B”)处的酒精灯。
(5)这套实验装置是否完整?____(填“是”或“否”)。若不完整,还须补充__(若第一空填“是”,则此空不需要作答)装置。
(6)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是____(填序号)。
①CO2 ②HCl ③H2O ④H2
A.①②③ B.②③④ C.②③ D.①④
【答案】25.0 250mL容量瓶 胶头滴管 BC ⑦ ⑥ ④ ⑤ MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 3Cl2+2Fe
Mn2++Cl2↑+2H2O 3Cl2+2Fe![]() 2FeCl3 吸收氯气中的水蒸气 吸收氯气中的氯化氢气体 A 否 尾气吸收 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O A
2FeCl3 吸收氯气中的水蒸气 吸收氯气中的氯化氢气体 A 否 尾气吸收 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O A
【解析】
Ⅰ.⑴某小组同学欲用4mol/L的盐酸配制230mL0.4mol/L盐酸溶液,![]() ,
,![]() ,即V(浓) = 0.025 L即25.0 mL,实验中需要用到的玻璃仪器有250 mL容量瓶、胶头滴管、量筒、烧杯、玻璃棒,
,即V(浓) = 0.025 L即25.0 mL,实验中需要用到的玻璃仪器有250 mL容量瓶、胶头滴管、量筒、烧杯、玻璃棒,
故答案为:25.0;250 mL容量瓶;胶头滴管;
⑵A选项,容量瓶洗涤后未干燥,干燥与未干燥,对结果无影响;
B选项,移液时,有少量溶液溅出,溶质减少,浓度偏低;
C选项,定容时,加水不慎超过刻度线,又倒出一些,溶质减少,浓度偏低;
D选项,定容时,俯视刻度线,溶液体积减小,浓度偏高;
综上所述,答案为BC;
Ⅱ.⑴用A装置制备氯气①,气体分别通入E盛有饱和氯化钠溶液的洗气瓶除去氯气中的氯化氢接⑦,⑥和D盛有浓硫酸的洗气瓶除去氯气中的水蒸气接④,⑤,除杂干燥后和B装置中的铁反应接②,装置C防止空气中的水蒸气进入,
故答案为⑦;⑥;④;⑤;②;
⑵A装置是实验室制氯气的反应,A的烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,B装置中发生反应的化学方程式为3Cl2+2Fe
Mn2++Cl2↑+2H2O,B装置中发生反应的化学方程式为3Cl2+2Fe![]() 2FeCl3,
2FeCl3,
故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;3Cl2+2Fe
Mn2++Cl2↑+2H2O;3Cl2+2Fe![]() 2FeCl3;
2FeCl3;
⑶容器D中装有浓硫酸,浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气;容器E中是饱和的氯化钠溶液,浓盐酸有挥发性,所以氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O= H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,所以D装置的作用是吸收氯气中的水蒸气,E装置的作用是吸收氯气中的氯化氢气,
故答案为:吸收氯气中的水蒸气;吸收氯气中的氯化氢气体;
⑷实验开始时,应先点燃A处的酒精灯,当排除装置内的空气后,再点燃B处酒精灯,
故答案为A;
⑸氯气有毒,污染环境,所以不能排空,所以这套实验装置不完整,这套实验装置不完整,因为没有为其处理装置,
故答案是:否;尾气吸收;
⑹工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,贮存很久的漂白粉变质变为碳酸钙,碳酸钙与浓盐酸制得的二氧化碳,可能含有的杂质气体是CO2,浓盐酸易挥发HCl,还有水蒸气,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;A。


科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含官能团的名称是______。
(2)反应⑤的化学方程式为______,该反应的反应类型是______。
(3)G的分子式为______。
(4)写出满足下列条件的E的同分异构体的结构简式:______、______。
Ⅰ.苯环上只有三个取代基
Ⅱ核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备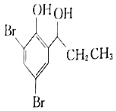 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下11.2LCH4在空气中完全燃烧,请完成下列问题:
(1)写出该反应的化学方程式_______;
(2)计算标准状况下11.2LCH4的质量_______;
(3)计算生成CO2的质量_______。[(2)(3)写出计算过程]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1molH2和1molI2在加热条件下充分反应,生成HI的分子数为2NA
B. 10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C. 20mL0.1 mol/LAlCl3溶液中,水解形成Al(OH)3胶体粒子数为0.002NA
D. 0.1molNa2O2和Na2O的混合物中含有的离子总数等于0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 1 L 1 mol/L葡萄糖溶液含有氧原子数为6NA
B. 氯气通入到含有1mol的FeBr2溶液中,当有NA个Br-被氧化时,共消耗标准状况下氯气22.4L
C. 标准状况下,2.24 L HF中所含质子数目为NA
D. 4.4 g由14CO2与14N2O组成的混合物中所含中子数为2.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的说法正确的是( )
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 中和滴定实验中,锥形瓶用蒸馏水洗净须经烘箱烘干后才可使用
C. 配制0.5mol·L-1480mL的NaOH溶液需称量9.6 g NaOH固体
D. 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是( )

A. a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
C. c点所示的溶液中c(Na+)=c(HClO)+c(ClO-)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com