
【题目】关于下列两个实验的说法正确的是( )
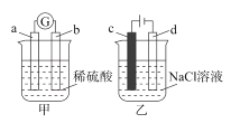
A.若甲中b电极的表面有气泡产生,则b为阳极
B.若甲中a为Zn,b为Cu,则正极附近的SO![]() 离子浓度逐渐增大
离子浓度逐渐增大
C.若乙中c电极为Fe,则电解一段时间后,溶液变浑浊
D.若乙中c、d均为惰性电极,产生22.4LCl2时,则转移电子2mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 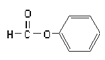 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
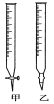
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
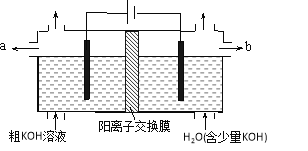
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.金属钠晶体中,Na的原子半径为acm,则其晶体密度为![]()
B.常温下醋酸铵溶液的pH=7,则0.1mol·L-1该溶液中c(CH3COO-)=c(NH![]() )=0.1mol·L-1
)=0.1mol·L-1
C.标准状况下,11.2L HF分子中F原子数为0.5NA
D.5.6g铁粉与稀硝酸反应,转移的电子数一定为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
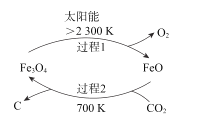
【题目】二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制炭黑的流程如图所示。总反应的化学方程式为__;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。
CH3OH+H2O。
已知298K和101kPa条件下:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;
2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
则CH3OH(l)的标准燃烧热ΔH=__;
(3)在催化剂M的作用下,CO2经过催化氢化合成低碳烯烃等。
CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH<0
CH2=CH2(g)+4H2O(g) ΔH<0
②2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
如图是乙烯在相同时间内,不同温度下的产率,当温度高于460℃时乙烯产率降低的原因不可能是__。
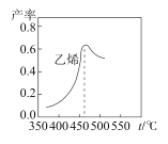
A.催化剂M的活性降低
B.①反应的平衡常数变大
C.生成甲醚的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三大化石燃料燃烧会产生大气污染物,特别是含硫煤燃烧后产生的SO2危害巨大。为了保护环境,科学家提出了下列解决方法,同时还能获得某种重要的工业产品。下列说法错误的是

A.不用O2直接氧化SO2是因为氧化速率太慢
B.图中涉及的反应之一为4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O
C.反应一段时间后,溶液中Fe2(SO4)3的浓度会减小
D.理论上每吸收标况下224mL SO2可以获得0.98gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年“新冠”疫情在全球肆虐。下列说法不正确的是( )
A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性
B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在![]() 之间
之间
C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物
D.“84”消毒液的主要成分是HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为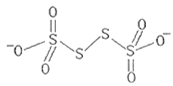 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com