
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A.NaH2PO4溶液pH<7,则在溶液中: c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)
B.0.1 mol·L-1(NH4)2SO4溶液与0.1 mol·L-1NH3·H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-)
C.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1CH3COOH溶液等体积混合(pH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)
D.0.2 mol·L-1NaHCO3溶液与0.1 mol·L-1Na2CO3溶液等体积混合: 2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
【答案】B
【解析】
A.NaH2PO4溶液的pH<7,溶液显酸性,说明![]() 的电离程度大于其水解程度,则c(
的电离程度大于其水解程度,则c(![]() )>c(H3PO4),浓度大小为:c(Na+)>c(
)>c(H3PO4),浓度大小为:c(Na+)>c(![]() )>c(
)>c(![]() )>c(H3PO4),故A错误;
)>c(H3PO4),故A错误;
B.0.1 mol·L-1(NH4)2SO4溶液与0.1 mol·L-1NH3·H2O溶液等体积混合,电荷守恒关系为:c(![]() )+c(H+)=2c(
)+c(H+)=2c(![]() )+c(OH-),故B正确;
)+c(OH-),故B正确;
C.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1CH3COOH溶液等体积混合(pH<7),说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),由物料守恒关系c(CH3COO-)+c(CH3COOH)=2c(Na+)知,c(CH3COO-)>c(Na+)>c(CH3COOH),浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;
D.0.2 mol·L-1NaHCO3溶液与0.1 mol·L-1 Na2CO3溶液等体积混合,物料守恒关系:3c(Na+)=4c(![]() )+4c(
)+4c(![]() )+4c(H2CO3),故D错误;
)+4c(H2CO3),故D错误;
综上所述,答案为B。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】实验室可用乙醇制备溴乙烷:CH3CH2OH+HBr![]() CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
A.制备过程中可能看到有气泡产生
B.可以将适量的NaBr、H2SO4(浓![]() 、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
C.如在夏天做制备CH3CH2Br的实验,实际收集到的产物可能较少
D.为了除去CH3CH2Br中混有的HBr,可用热的NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为__________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________ (用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某线型高分子化合物的结构简式如图所示:
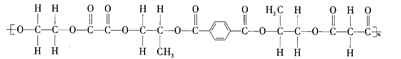
下列有关说法正确的是( )
A.该高分子化合物是由4种单体缩聚而成的
B.形成该高分子化合物的几种羧酸单体互为同系物
C.形成该高分子化合物的单体中的乙二醇可被![]() 催化氧化生成草酸
催化氧化生成草酸
D.该高分子化合物有固定的熔沸点,1mol该高分子化合物完全水解需要氢氧化钠的物质的量为5nmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,其晶体中阴离子的最小结构单元如图所示。它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,则下列说法正确的是( )
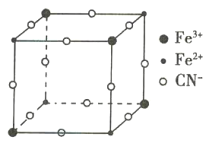
A.x=2,y=1
B.该晶体属于离子晶体,M呈+1价
C.M的离子不可能在立方体的体心位置
D.该晶胞中与每个Fe3+距离最近且相等的CN-有3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子的最外层电子数是其内层电子数的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且元素Y的基态原子核外p电子比s电子多5个。
(1)Z的基态原子的核外电子排布式为____________________。
(2)Z的氧化物是石油化工中重要的催化剂之一,可催化异丙苯裂化生成苯和丙烯
①1 mol丙烯分子中含有![]() 键与
键与![]() 键数目之比为__________________。
键数目之比为__________________。
②苯分子中碳原子的杂化类型为_________________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为______________。
(3)W、X、Y三种元素的电负性由小到大的顺序为_________________(用元素符号表示)。
(4)ZY3的熔点为1152℃,其在熔融状态下能够导电,据此可判断ZY3晶体属于____________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图所示。若该化合物的相对分子质量为M,晶胞边长为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_________ g/cm3。
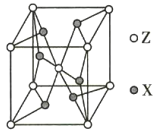
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池领域 作出贡献的三位科学家。他们于 1972年提出“摇椅式“电池 ( Rock ing chair battery), 1980年开发出 LiCoO2材料, 下图是该电池工作原理图,在充放电过程中, Li+在两极之间“摇来摇去”,该电池充电时的总反应为:LiCoO2+ 6C ( 石墨)=Li (1-x)CoO2+LixC6。下列有关说法正确的是
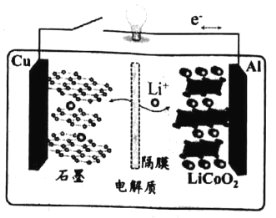
A.充电时,Cu 电极为阳极
B.充电时,Li+将嵌入石墨电极
C.放电时,Al 电极发生氧化反应
D.放电时,负极反应 LiCoO 2—xe-=Li (1-x)CoO2+ (1-x ) + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com