
| V3-(V2-V1) |
| 22400 |
106g/mol×
| ||
| mg |
106g/mol×
| ||
| mg |


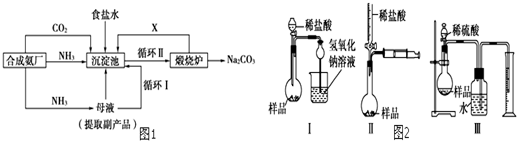
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、可以用氢氧化铜悬浊液检验甘油和酒精 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、由金属元素和非金属元素形成的化学键一定是离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
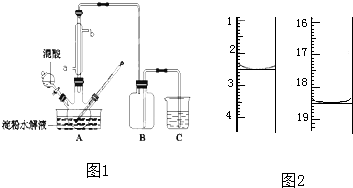
查看答案和解析>>
科目:高中化学 来源: 题型:
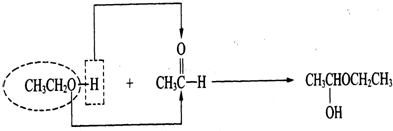
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体 |
| B、将乙醇加热到170℃可制得乙烯 |
| C、用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯 |
| D、用饱和的Na2CO3溶液除去CO2中的HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com