
 ��������Դ��һ����ȾС�Ŀ�������Դ���������Ƶö��ֻ���ԭ�ϣ����ȩ���״��Ͷ����ѵȣ�
��������Դ��һ����ȾС�Ŀ�������Դ���������Ƶö��ֻ���ԭ�ϣ����ȩ���״��Ͷ����ѵȣ�| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO��2molH2 | 1mol CH3OH | 2molCO��4molH2 |
| CH3OHƽ��ʱŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | a1 | a2 | a3 |
���� ��1����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-566.0kJ•mol-1
��H2O��g���TH2O��l����H=-44.0kJ•mol-1
���ݸ�˹���ɣ�����֪��Ӧ$\frac{1}{2}$������-��+�ۡ�4���õ��Ȼ�ѧ����ʽ��
��2�����������غ㶨�ɺͻ��Ϸ�Ӧ�Ķ�����ص��жϣ���Ҫ�����÷�Ӧǰ��ԭ�ӵ�����䣬����Ŀ�ر��ֲ�������жϣ�
��3����a��v��CO��=2v��H2�������㻯ѧ��Ӧ����֮�ȵ��ڼ�����֮�ȣ�
b�����º�ѹ�£����ﵽƽ��ʱ��������䣬��������������ܶȲ��䣻
c����ԭƽ����ϵ�г���һ�����ĺ�����ƽ�ⲻ�ƶ���
d����H��ֵ��Ͷ�����أ�
e���¶�һ��ʱ����С�����������ƽ���������С�ķ����ƶ���
�ڼ�������Ӧ��Ͷ��1molCO.2molH2����������Ӧ��Ͷ��1mol CH3OH�ڱ��ֺ��¡�����������ǵ�Чƽ�⣬ƽ��ʱCH3OH��Ũ��c1=c2 ����1+��2=1��Q1+Q2�����ܱ仯�൱��1molCO.2molH2��ȫת����1mol CH3OH����������������Q1+Q2��ֵ�Ͼ͵���90.8kJ����������Ӧ��Ͷ����1molCO��2molH2���������Ӧ��Ͷ����2molCO��4molH2���������ұ������ݻ��Ǽ�����2������������������Ҳ�ǵ�Чƽ�⣬Ȼ���������¶ȡ��ݻ���ͬ��3���ܱ����������Ե������ں������ݻ��Ǽ��������������£�����ܵ���ѹ����ԭ��Ӧ��������������٣���ƽ���ƶ�ԭ����������ڼ������������״�������ԣ�������ƽ���������ƶ���Ҳ����˵����������ת���ʱȼ�������Ҫ��һЩ�����2c1��c3����2����3����Ӧ����ͬ�¶��½��У�ƽ�ⳣ����ȣ�
��4����ת����Ϊx��
�� 3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g��
��ʼ��mol�� 3 3 0 0
ת����mol�� 3x 3x x x
ƽ�⣨mol�� 3-3x 3-3x x x
���ʵ�֮�ȵ���ѹǿ֮�ȣ��ɼ���ת���ʣ�
��5��a�����ѱ���������ˮ�Ͷ�����̼��Ϊԭ��صĸ�����
��� �⣺��1����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-566.0kJ•mol-1
��H2O��g���TH2O��l����H=-44.0kJ•mol-1
���ݸ�˹���ɣ�����֪��Ӧ$\frac{1}{2}$������-��+�ۡ�4���õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ�ġ�H=$\frac{1}{2}$��[��-1275.6kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-442.8kJ•mol-1����CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ•mol-1��
��2������ɫ��ѧ����ʵ�����ŷţ�����Ӧ���е�ԭ�������ʴﵽ100%��Ҳ����˵��Ӧ����һ���ǻ��Ϸ�Ӧ���ҷ�Ӧ������еĸ�ԭ����Ŀ�Ȳ��䣬CO��H2��һ�������°��ղ�ͬ�ı�����Ӧ���ɼٶ���Ӧʱ�Ļ�ѧ������֮��Ϊ1��1����ֻҪ��ѡ���еĻ�ѧʽ�ܻ�Ϊ��ʽ��CO��n��H2��n��������ȷ�ģ������ǻ����״���CH4O���ɱ�Ϊ��CO��1��H2��2����ȩ��CH2O���ɱ�Ϊ��CO��1��H2��1�����ᣨC2H4O2���ɱ�Ϊ��CO��2��H2��2���ʴ�Ϊ��cd��
��3����a��v��CO��=2v��H2�������㻯ѧ��Ӧ����֮�ȵ��ڼ�����֮�ȣ�����˵���ﵽƽ��״̬����a����
b�����º�ѹ�£����ﵽƽ��ʱ��������䣬��������������ܶȲ��䣬��˵���ﵽƽ��״̬����b��ȷ��
c����ԭƽ����ϵ�г���һ�����ĺ������μӷ�Ӧ�����Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ�����c��ȷ��
d����H��ֵ��Ͷ�����أ���d��ȷ��
e���¶�һ��ʱ����С�����������ƽ���������С�ķ����ƶ������������ƶ�����e��ȷ��
�ʴ�Ϊ��a��
�ڼ�������Ӧ��Ͷ��1molCO.2molH2����������Ӧ��Ͷ��1mol CH3OH�ڱ��ֺ��¡�����������ǵ�Чƽ�⣬ƽ��ʱCH3OH��Ũ��c1=c2 ����1+��2=1��Q1+Q2�����ܱ仯�൱��1molCO.2molH2��ȫת����1mol CH3OH����������������Q1+Q2��ֵ�Ͼ͵���90.8kJ����������Ӧ��Ͷ����1molCO��2molH2���������Ӧ��Ͷ����2molCO��4molH2���������ұ������ݻ��Ǽ�����2������������������Ҳ�ǵ�Чƽ�⣬Ȼ���������¶ȡ��ݻ���ͬ��3���ܱ����������Ե������ں������ݻ��Ǽ��������������£�����ܵ���ѹ����ԭ��Ӧ��������������٣���ƽ���ƶ�ԭ����������ڼ������������״�������ԣ�������ƽ���������ƶ���Ҳ����˵����������ת���ʱȼ�������Ҫ��һЩ�����2c1��c3����2����3����Ӧ����ͬ�¶��½��У�ƽ�ⳣ����ȣ�
a�������Ϸ�����֪c3��2c1=2c2����a��ȷ��
b�������Ϸ�����֪��������ת���ʱȼ�������Ҫ��һЩ����Q3��2Q1����b����
c����Ӧ�¶���ȣ���ƽ�ⳣ����ȣ���c��ȷ��
d�������Ϸ�����֪��1+��2=1����1����3����a2+a3��100%����d����
�ʴ�Ϊ��ac��
��4����ת����Ϊx��
�� 3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g��
��ʼ��mol�� 3 3 0 0
ת����mol�� 3x 3x x x
ƽ�⣨mol�� 3-3x 3-3x x x
���ʵ�֮�ȵ���ѹǿ֮�ȣ���$\frac{3-4x}{6}$=$\frac{{p}_{0}}{p}$��
x=$\frac{3��p-{p}_{0}��}{2{p}_{0}}$��100%��
�ʴ�Ϊ��$\frac{3��p-{p}_{0}��}{2{p}_{0}}$��100%��
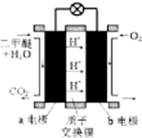
��5����ͼ֪��a�缫��������ˮ��Ӧ���ɶ�����̼�������ӣ���a�缫�ķ�ӦʽΪ��CH3��2O-12e-+3H2O=2CO2+12H+��
�ʴ�Ϊ����CH3��2O-12e-+3H2O=2CO2+12H+��
���� ���⿼���Чƽ�⣬��ѧƽ��ļ��㣬��ѧ��Դ���͵�صȣ�Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬�ѶȽϴ�ע�⻯ѧƽ��ļ����DZ�����ѵ㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X �� Y ֻ���γ�һ�ֻ����� | |
| B�� | ���ʵ������ԣ�X��M | |
| C�� | ��̬�⻯����ȶ��ԣ�M��N | |
| D�� | ����������Ӧˮ����ļ��ԣ�Y��Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
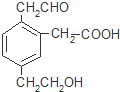 ������һ�������¿��ܷ����ķ�Ӧ�ǣ�������
������һ�������¿��ܷ����ķ�Ӧ�ǣ�������| A�� | �٢ۢܢݢޢ� | B�� | �ڢۢܢݢ� | C�� | �٢ۢݢޢ� | D�� | �٢ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ���ᱣ������ɫ�����Լ�ƿ�� | |
| B�� | �������Ʊ�����ú���� | |
| C�� | ����������Һ�����ڴ���Ƥ���IJ����Լ�ƿ�� | |
| D�� | FeSO4��Һ�м�������Fe�ۺ�ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪���л��Ȼ���������SO2Cl2���Ʒ���SO2��g��+Cl2��g��?SO2Cl2��g����H��0
��֪���л��Ȼ���������SO2Cl2���Ʒ���SO2��g��+Cl2��g��?SO2Cl2��g����H��0| c��SO2��/mol•L-1 | c��Cl2��/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ۡ������ǡ�CO2��H2O���ͷ�����ά��������� | |
| B�� | ��ά�ء������ǡ�CO2��H2O���ͷ�����ά��������� | |
| C�� | ��֬�����ͺ�֬�����CO2��H2O���ͷ�����ά��������� | |
| D�� | ��ѿ�ǡ������ǡ�CO2��H2O���ͷ�����ά��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com