
【题目】下列叙述正确的是( )
A. 石油裂解是为了获得更多汽油,以满足迅速增长的汽车需要
B. 1mol冰醋酸和1mol乙醇反应生成的水分子数目为NA
C. 沸点:汽油<煤油<柴油<润滑油
D. 乙酸分子中不含醛基,所以不能与新制的Cu(OH)2悬浊液反应
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 电解后,电解槽底部的阳极泥中只有金属Pt
B. 电解过程中,电解质溶液的质量可能保持不变
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 阳极发生氧化反应,其电极反应式:Ni2++2e-![]() Ni
Ni
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示戊烷燃烧热的热化学方程式正确的是
A.C5H12(l)+8O2(g)===5CO2(g)+6H2O(l) ΔH=3 540 kJ·mol1
B.C5H12(l)+8O2(g)===5CO2(g)+6H2O(g) ΔH=3 540 kJ·mol1
C.C5H12(l)+8O2(g)===5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol1
D.C5H12(l)+8O2(g)===5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g) ![]() 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
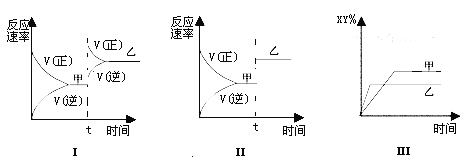
A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式____________________________。
(2)已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:

下列说法正确的是______________________(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.4min内CO2的反应速率为0.003 mol/(L·min)
D.第8min时,若充入氦气,不会导致v正(CO) < v逆(H2O)
(3)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,amol CO2和bmol H2。若达平衡时各组分体积分数都与(2)中平衡时相同,则a=____________mol,b=________mol。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是_________________。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑,则阴极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1 NA
D. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() +
+![]() +10
+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10 NA
)数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 金属阳离子被还原后,一定得到该元素的单质
B. 元素由化合态变成游离态时,它可能被氧化,也可能被还原
C. 失电子难的原子,获得电子的能力一定强
D. 有单质参加或生成的反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度在实验、科研与生产中有着广泛的应用:
(1)实验室需要配制250mL 0.2mol/L NaOH溶液,
① 应称取NaOH固体的质量为____
② 除了天平、药匙、烧杯、胶头滴管与玻璃棒外,还需使用的仪器是______.
③ 实验的正确操作顺序是(填写字母,每项限选一次)______.
A.称量 B.溶解 C.洗涤和转移 D.定容 E.转移 F.摇匀 G.冷却
④ 配制过程中,下列情况会使配制结果偏高的是(填写字母)______.
A.氢氧化钠溶解后,没有冷却就转入到容量瓶内 B.定容时,俯视容量瓶加水到刻度线
C.加水超过刻度线,再取出多余的水 D.配制前容量瓶内有少量蒸馏水
(2)把amol/L CuSO4溶液和bmol/L H2SO4溶液等体积混合(设混合后体积为混合前两溶液体积之和),则混合液中H+、SO42﹣的物质的量浓度分别是c(H+)=_______mol/L;
c(SO42﹣)=____mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol,下列说法中正确的是( )
A.该反应中熵变小于0,焓变大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解都能自发进行
D.判断反应能否自发进行需要根据△H与△S综合考虑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com