
【题目】莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
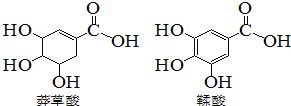
A. 莽草酸分子式为C7H10O5
B. 两种酸都能与溴水发生加成反应
C. 鞣酸分子与莽草酸分子互为同系物
D. 等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的物质的量相同
科目:高中化学 来源: 题型:
【题目】I:一定条件下,在体积为3 L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
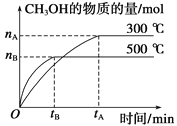
(2)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是______________(用nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
II:现有可逆反应.2NO2(g) ![]() N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
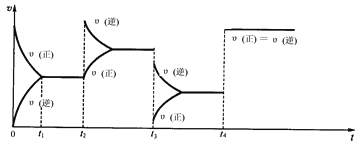
(1)t2:_________________________________________________;
(2)t3:_________________________________________________;
(3)t4:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A. 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
B. 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA
C. 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
D. 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,2体积某烃和8体积O2混合,完全燃烧后恢复到原来的温度和压强,体积不变,该分子式中所含的碳原子数不可能是( )
A. 1 B. 2 C. 3 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。
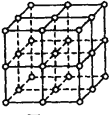
这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体的结构示意图。_______
(2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-离子为该晶胞与其相邻的晶胞所共有。一个晶胞中,Cl-离子的个数等于______,即______(填计算式),Na+离子的个数等于_______,即__________(填计算式)。
(4)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为![]() g/cm3,阿伏加德罗常数为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
g/cm3,阿伏加德罗常数为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:


(1)仪器c的名称为___________,温度计的作用是___________________________。
(2)在a中加入30mL无水苯和少量铁屑。在b中小心加入8.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_____气体。继续滴加至液溴滴完,装置d的作用是___________________;
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入15mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_____。
③向分出的粗溴苯中加入少量的无水氯化钙进行吸水干燥,静置、过滤。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质的结构简式为_________,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是_________(填入正确选项前的字母)。
A.25mL B.50mL C.100mL D. 250mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示实验,现象和结论均正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和 SO32- |
D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3 +KSCN |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等单质及化合物的应用广泛。
(1)LiFePO4是锂离子电池材料,画出Fe2+的价层电子排布图____________,其中PO43-的立体构型是____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
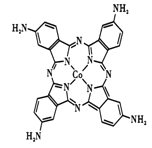
①写出氨基钴酞菁中N 原子的杂化轨道类型____________;
②写出一种与氨基阴离子NH2-互为等电子体的中性分子____________;
③将“钴酞菁”改性为“氨基钴酞菁”后,能使其水溶性得到有效改善,请简述其原因:____________
(3)1mol[Co(NO2)6]3-中所含的σ键数目是____________。K3[Co(NO2)6]中四种元素的第一电离能由大到小的顺序是____________。
如图所示为NiO晶体的晶胞结构示意图:
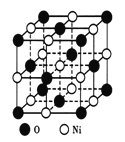
①该晶胞中占有阴阳离子总数是____________;
②己知在NiO晶体中Ni2+的半径为a pm,O2-的半径为bpm,它们在晶体中是紧密接触的,则在NiO晶体中原子的空间利用率为____________。(用含字母a、b的计算式表达)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com