
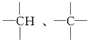 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)分析 (1)根据烷烃通式确定C原子与H原子之间的数量关系,或根据伯、仲、叔、季碳原子上含有H原子数目确定;
(2)n=2(n1+n2+n3+n4)+2=n=3n1+2n2+n3化简计算.
解答 解:(1)由于烷烃的通式为CnH2n+2,C原子与H原子之间的数量关系为n=2(n1+n2+n3+n4)+2,
伯、仲、叔、季碳原子上含有的H原子数目分别为3、2、1、0,所以C原子与H原子之间的数量关系为n=3n1+2n2+n3,
故答案为:2(n1+n2+n3+n4)+2;3n1+2n2+n3;
(2)由(1)中可得,2(n1+n2+n3+n4)+2=3n1+2n2+n3,故n3+2n4+2=n1,
故答案为:n3+2n4+2=n1.
点评 本题考查了烷烃的结构,明确烷烃的通式是关键,难度不大,注意基础知识的掌握.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中 | |
| B. | AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案 | |
| C. | AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨 | |
| D. | AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| D. | 铅蓄电池充电时Pb极与外电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
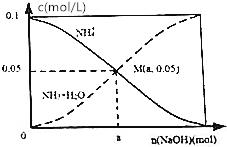 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质能从Z的盐溶液中置换出Z | B. | 氢化物的热稳定性:X>W | ||
| C. | Y、Z两元素只能形成阳离子 | D. | 简单离子的半径大小:W>Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com