
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2下列有关说法正确的是
Li2O2下列有关说法正确的是
A.充电时,多孔金制成的电极外接电源负极
B.放电时,Li+从负极向正极移动
C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
D.该电池可使用含Li+的水溶液作电解质溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届宁夏中卫一中高三上学期期末理综化学试卷(解析版) 题型:填空题
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1)。完成下列填空:
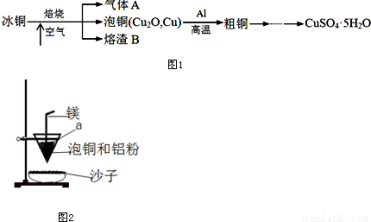
(1)气体A中的大气污染物可选用下列试剂中的________(填序号)吸收。
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是____________________;
②装置中镁带的作用是____________________;
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是____________;
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数.(不考虑H2S的自身分解)______________已知:氧气不足时:2H2S+O2  2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
(4)已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) △H1=47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) △H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:实验题
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀 (填操作名称)、洗涤、烘干、称量、计算。洗涤沉淀的具体操作是 。
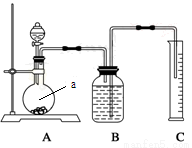
方案二:把一定量的样品与足量硫酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 。下图装置中实验仪器a的名称是 。
方案三:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。
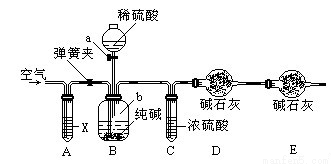
(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”)。
(2)装置A中试剂X应选用 。
(3)E装置的作用是 。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为 (结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
在恒温恒容密闭容器中,将CO和H2S混合并达到下列平衡:CO (g) +H2S (g)  COS (g) +H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS (g) +H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.若容器内压强不再变化,则说明该反应己达平衡
B.反应前H2S物质的量为2.5mol
C.CO和H2S达平衡后的转化率相同
D.若平衡后再加入CO,则正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学卷(解析版) 题型:选择题
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是( )
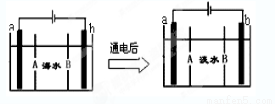
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,a电极的电极反应式为 4OH--4e-=O2↑ +2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第二次质检化学试卷(解析版) 题型:填空题
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:
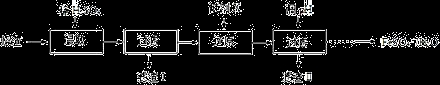
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为_____________。能提高烧渣浸取速率的措施有________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是______________(填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有_________________。
(3)滤渣Ⅱ主要成分的化学式为_______________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_____________、_____________过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省孝义市高一下学期升级考试化学试卷(解析版) 题型:实验题
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________。
(2)在烧瓶中配制一定比例的乙醇和浓硫酸的混合液的方法是:__________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______________,原因是____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
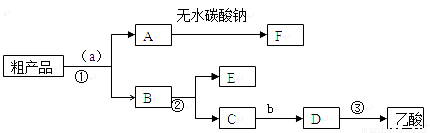
试剂a是__________,试剂b是__________;分离方法①是__________,分离方法②是__________,分离方法③是____________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省邵阳市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.玛瑙手镯、水晶项链、餐桌上的陶瓷碗盘都是硅酸盐制品
B.二氧化硅晶体广泛用于制作太阳能电池和光导纤维
C.制造水泥、玻璃的原料都有石灰石、纯碱、石英
D.粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一上学期12月月考化学试卷(解析版) 题型:填空题
Ⅰ.在MgCl2溶液中滴入NaOH溶液,会有白色沉淀出现,该白色沉淀不能溶解于过量的氢氧化钠中。反应的离子方程式是 ;但Al(OH)3却能溶解在过量NaOH溶液中,该反应的离子方程式是 。
Ⅱ.在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示。
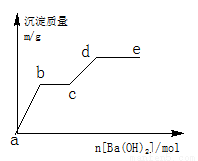
(1)a→b过程中发生反应的离子方程式是
(2)b→c发生反应的离子方程式是
(3)d点沉淀质量是 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com