
如图表示外界条件(温度、压强)的变化对下列反应的影响:
L (s) + G (g)![]() 2R (g)△H>0,图中y轴是指( )
2R (g)△H>0,图中y轴是指( )

A.平衡混合气中R的百分含量
B.平衡混合气中G的百分含量
C.G的转化率
D.L的转化率
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三第三次模拟理综化学试卷(解析版) 题型:填空题
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题:
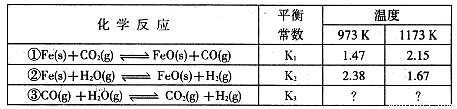
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示:
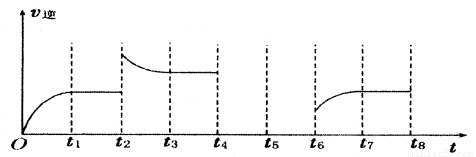
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。
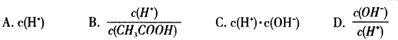
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com