
【题目】下列表示对应化学反应的离子方程式正确的是
A. FeCl3溶液与Cu的反应:Cu+Fe3+==Cu2++Fe2+
B. NO2与水的反应:3NO2+H2O==2NO3-+NO+2H+
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+==Ca2++H2O+CO2![]()
D. 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O==2Al(OH)3![]() +CO32-
+CO32-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氯气、液氯和氯水是同一种物质,只是状态不同,都属于纯净物
B.氯气是纯净物,氯水是混合物
C.铁丝在氯气中燃烧生成黄色固体FeCl2
D.新制的氯水只含有氯气分子和水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、A12O3,不考虑其他杂质)制取FeSO4·7H2O,其制备工艺流程如下:
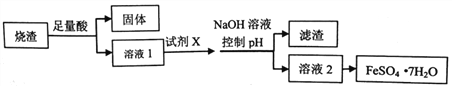
结合所学知识回答:
(1)溶解烧渣选用的酸应为_____(填化学式),选用的试剂X为_____(填试剂名称)。
(2)加入NaOH控制pH的目的是____________。
(3)从溶液2得到FeSO4·7H2O的实验操作主要步骤是________________________。
(4)为了测定获得的绿矾产品的纯度,进行了如下实验操作:
I.称取2.850g绿矾产品,溶解,用250mL容量瓶配制成待测液;
II.量取25.00mL待测溶液置于锥形瓶中;
III.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的方法是____________。
②该滴定反应的离子方程式为___________________。
③上述样品中FeSO4·7H2O的纯度为____________________。
(5)古代炼丹家以绿矾(FeSO4·7H2O)为原料,放在炼丹炉中锻烧可制得绿矾油。下图是2.780 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液,得到白色沉淀1.165 g。则t1~t2段发生反应的化学方程式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
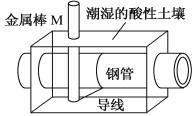
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒M的材料应该是比镁活泼的金属
C.金属棒M上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是( )
A.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围:![]() a mol≤ne≤
a mol≤ne≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是
A. Cl2B. MgC. CuD. H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和S![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
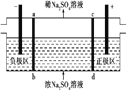
A. 通电后中间隔室的S![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成
C. 负极反应为2H2O-4e-![]() O2+4H+,负极区溶液pH降低
O2+4H+,负极区溶液pH降低
D. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com