
| A. | c(Ba2+)>c(OH-)>c(Na+)>c(CO32-) | B. | c(OH-)>c(Na+)>c(Ba2+)>c(CO32-) | ||
| C. | c(OH-)>c(Ba2+)>c(Na+)>c(CO32-) | D. | c(Na+)>c(OH-)>c(Ba2+)>c(CO32-) |
分析 将0.2mol/L的氢氧化钡溶液和0.15mol/L的碳酸氢钠溶液等体积混合,Ba(OH)2+NaHCO3=BaCO3↓+NaOH+H2O,设溶液体积都是1L,n(Ba2+)=0.2mol,n(OH-)=0.4mol,n(Na+)=0.15mol,n(HCCO3-)=0.15mol,混合反应Ba2++OH-+HCO3-=BaCO3↓+H2O,反应后溶液中存在离子物质的量为n(Ba2+)=0.2mol-0.15mol=0.05mol,n(Na+)=0.15mol,n(OH-)=0.4mol-0.15mol=0.25mol,据此比较离子浓度大小;
解答 解:将0.2mol/L的氢氧化钡溶液和0.15mol/L的碳酸氢钠溶液等体积混合,Ba(OH)2+NaHCO3=BaCO3↓+NaOH+H2O,设溶液体积都是1L,n(Ba2+)=0.2mol,n(OH-)=0.4mol,n(Na+)=0.15mol,n(HCCO3-)=0.15mol,混合反应Ba2++OH-+HCO3-=BaCO3↓+H2O,反应后溶液中存在离子物质的量为n(Ba2+)=0.2mol-0.15mol=0.05mol,n(Na+)=0.15mol,n(OH-)=0.4mol-0.15mol=0.25mol,溶液中离子浓度大小为:c(OH-)>c(Na+)>c(Ba2+)>c(CO32-),
故选B.
点评 本题考查了电解质溶液中离子浓度比较、反应定量关系的判断,主要是溶液中离子存在和浓度大小的比较方法,掌握基础是解题关键,题目难度中等.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有 x+1 | B. | 可能是 x+8或 x+18 | ||
| C. | 可能是 x+2 | D. | 可能是 x+1或 x+11或x+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 升高温度该反应的平衡常数K减小 | |
| B. | 该反应的△S<0 | |
| C. | 反应达平衡时吸热15.9kJ | |
| D. | 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
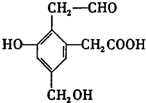 某有机物A结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
某有机物A结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )| A. | 6:4:6 | B. | 4:6:5 | C. | 2:3:2 | D. | 2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com