
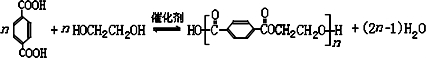
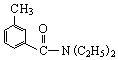 ; DEET在一定条件下,可通过下面的路线来合成:
; DEET在一定条件下,可通过下面的路线来合成: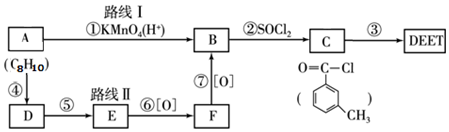
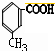 .
.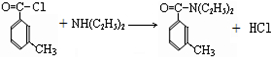 .
. .
. 分析 A的分子式为C8H10,由C的结构和题中信息反应原理可知A的结构简式为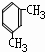 、B为
、B为 ;F可氧化为B,则F的结构简式为
;F可氧化为B,则F的结构简式为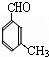 ,E为
,E为 ,则A生成D的反应应为A和氯气发生取代反应生成
,则A生成D的反应应为A和氯气发生取代反应生成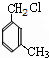 ,
, 发生水解(或取代)生成
发生水解(或取代)生成 ,然后结合有机物的结构和性质解答该题.
,然后结合有机物的结构和性质解答该题.
解答 解:(1)A.避蚊胺中苯环上含有甲基,与酸性高锰酸钾发生氧化还原反应,它能使酸性高锰酸钾溶液褪色,故A正确;
B.避蚊胺中不含-COOH或-OH,不能发生酯化反应,故B错误;
C.避蚊胺中含有N元素,不属于烃,它与甲苯不是同系物,故C错误;
D.避蚊胺含有苯环,一定条件下,它可与H2发生加成反应,故D正确;
故答案为:AD;
(2)根据分析可知,B的结构简式为: ,
,
故答案为: ;
;
(3)根据分析可知:反应④A生成D的反应应为A和氯气发生取代反应生成 ,反应⑤为
,反应⑤为 发生水解(或取代)生成
发生水解(或取代)生成 ,反应⑥⑦为氧化反应,所以④⑤为取代反应,
,反应⑥⑦为氧化反应,所以④⑤为取代反应,
故答案为:④⑤;
(4)对比C和DEET的结构可知C生成DEET的反应为取代反应,反应的方程式为: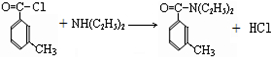 ,
,
故答案为: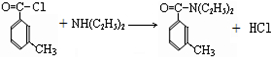 ;
;
(5)E为 ,同分异构体能与FeCl3溶液发生显色的反应,说明含有酚羟基,且结构中不含乙基,则应含有2个甲基,可能的结构简式为:
,同分异构体能与FeCl3溶液发生显色的反应,说明含有酚羟基,且结构中不含乙基,则应含有2个甲基,可能的结构简式为: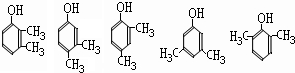 、
、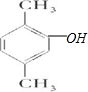 ,总共有6种,
,总共有6种,
故答案为:6;
(5)A为 ,A的某种同分异构体J只有两个吸收峰,说明J中的甲基应位于对位,名称为1,4二甲基苯或对二甲苯;
,A的某种同分异构体J只有两个吸收峰,说明J中的甲基应位于对位,名称为1,4二甲基苯或对二甲苯;
酸性高锰酸钾氧化后得到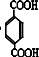 ,与乙二醇发生缩聚反应,反应的化学方程式为:
,与乙二醇发生缩聚反应,反应的化学方程式为: ,
,
故答案为:1,4二甲基苯或对二甲苯; .
.
点评 本题考查有机物的合成和推断,题目难度中等,注意由C的结构为突破口推断A为解答该题的关键,本题中注意同分异构体的判断,为易错点,要求学生熟练掌握常见有机物结构与性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
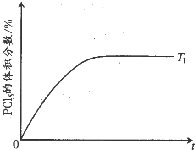
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA | |
| B. | 在标准状况下,1 mol H2O的体积可能是22.4 L | |
| C. | 当温度高于0℃时,一定量任何气体的体积都大于22.4 L | |
| D. | 标况下,某气体的体积为22.4 L,则该气体的物质的量为1 mol,所含的分子数目约为:6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
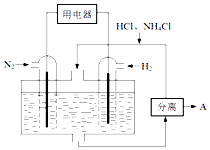 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com