
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
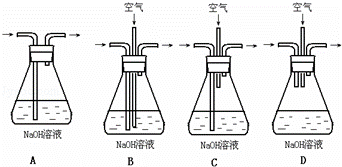
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为 ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 .
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10﹣5mol•L﹣1,就认为沉淀完全),然后过滤、浓缩、结晶.
已知:Ksp≈10﹣22,Ksp≈10﹣16,Ksp≈10﹣38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是 .
②为了使铁元素全部沉淀,应调节pH至少为 .
③方案2中甲物质可选用的是 .
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 .
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL 1.5mol•L﹣1的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4•5H2O的产率为 .
考点:
制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;硝酸的化学性质.
专题:
电离平衡与溶液的pH专题;氮族元素.
分析:
(1)依据铜和稀硝酸反应的离子方程式,理解反应实质氢离子是硫酸和硝酸提供;尾气只要是一氧化氮、二氧化氮,需要和氧气混合通入碱溶液中完全吸收;
(2)①固体灼烧应在坩埚内;
②依据Ksp和一般认为铁离子的浓度下降到10﹣5mol•L﹣1,就认为沉淀完全,计算溶液PH;
③调节溶液PH和溶液中氢离子反应,提高溶液PH,但不能引入新的杂质;
④亚铁离子在空气中易被氧化为铁离子,铜能溶解于含铁离子的溶液中;
⑤根据双氧水加热易分解的性质分析;
⑥依据固体条件结合得到硫酸铜晶体质量计算得到.
解答:
解:(1)验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,反应的离子方程式为:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,依据离子反应实质,氢离子是硝酸和硫酸共同提供,氢离子分析可知最佳比为6:2,所以硫酸和硝酸物质的量之比最佳为3:2;吸收该反应中产生的尾气氮的氧化物需要通入氧气混合后通入氢氧化钠溶液被完全吸收;
A、一氧化氮不能被氢氧化钠吸收,故A错误;
B、空气和一氧化氮通入氢氧化钠溶液可以被吸收,故B正确;
C、空气未通入氢氧化钠溶液,一氧化氮不能在溶液中和氧气反应被氢氧化钠吸收,故C错误;
D、气体都未通入氢氧化钠溶液中,不能被吸收,故D错误;
故答案为:3:2;B;
(2)①固体在空气中灼烧需要高温应在坩埚内完成,故答案为:坩埚;
②Ksp≈10﹣38 ,依据沉淀溶解平衡可知,c(Fe3+)×c3(OH﹣)=10﹣38,一般认为铁离子的浓度下降到10﹣5mol•L﹣1,
c(OH﹣)=10﹣11mol/L,c(H+)=10﹣3mol/L,pH=3,故答案为:3;
③除杂的原则,保证不引入杂质,加入氧化铜或碱式碳酸铜都能能和酸反应提高溶液PH,但不引进新的杂质,加入CaO、NaOH、Fe2(SO4)3会引入新的杂质离子,得不到纯净的硫酸铜晶体,故答案为:CD;
④反应中加入少量FeSO4可加速铜的氧化,亚铁离子酸性溶液中被空气中的氧气氧化为铁离子,铁离子溶解铜生成硫酸铁和硫酸铜,反应的两种方程式为:4Fe2++O2+4H+═4Fe3++2H2O; 2Fe3++Cu═2Fe2++Cu2+,故答案为:4Fe2++O2+4H+═4Fe3++2H2O,2Fe3++Cu═2Fe2++Cu2+;
⑤过氧化氢不稳定,温度过高易分解生成水和氧气,故答案为:防止双氧水分解;
⑥设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4•5H2O
64g 250g
3.2g xg
所以x=12.5
理论上生成CuSO4•5H2O 12.5克,故产率为 ×100%=84.8%,
×100%=84.8%,
故答案为:84.8%.
点评:
本题考查了制备物质的实验设计和方案探究,实验装置的应用分析,物质性质的判断,氧化还原反应的分析,尾气处理方法,溶液PH的计算,制备物质产率计算,题目综合性强,需要扎实的基础知识,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
在a g环已烷,乙醛,葡萄糖,甲酸甲酯的混合物中,已知氧元素的质量分数为b,则碳元素的质量分数是( )
|
| A. | 1﹣b | B. |
|
|
| C. |
| D. | 数据不全无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质用途的叙述中,不正确的是( )
|
| A. | 硅可用于制作半导体材料 |
|
| B. | 二氧化硅可用于制造光导纤维 |
|
| C. | 石墨可用作绝缘材料 |
|
| D. | 液氨可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
酯类物质广泛存在于香蕉、梨等水果中.某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H13OH的物质.对于此过程,以下分析中不正确的是( )
|
| A. | C6H13OH分子含有羟基 |
|
| B. | C6H13OH可与金属钠发生反应 |
|
| C. | 实验小组分离出的酯可表示为CH3COOC6H13 |
|
| D. | 不需要催化剂,这种酯在水中加热即可大量水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X﹣和Y﹣组成的盐溶液.据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
|
| A. | BX | B. | AX | C. | AY | D. | BY |
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,能达到实验目的是( )
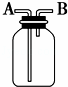
A. 瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B. 从B口进气,用排空气法收集CO2
C. 瓶中盛满水,从B口进气,用排水法收集NO2
D. 瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A. 反应中硫元素被氧化,所有铁元素均被还原
B. 氧化剂是Fe3+,氧化产物是Cu2+
C. 反应中转移电子的物质的量为xmol
D. 反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌.NaNO2有像食盐一样的咸味,能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
(1)上述反应中若有1.75mol的还原剂被氧化,则被还原的氧化剂是 mol.
(2)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂 能使NaNO2转化为不引起二次污染的N2.(填编号)①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为 .若此废水呈强碱性,需调节溶液的pH接近中性,再添加氯化铵溶液,否则会引起二次污染,反应的方程 .
(3)向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式与事实不相符的是
A.OH﹣+CO32﹣+2H+→HCO3﹣+H2O B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O D.OH﹣+CO32﹣+3H+→CO2↑+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家研究发现:等电子体的空间结构相同,则下列有关说法中正确的是( )
|
| A. | BF3和CO32﹣是等电子体,均为平面正三角形结构 |
|
| B. | B3N3H6和苯(C6H6)是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 |
|
| C. | NH3和PCl3是等电子体,均为三角锥形结构 |
|
| D. | CH4和NH4+是等电子体,键角均为60° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com