
【题目】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
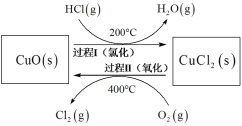
过程I的反应为:2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
①过程II反应的热化学方程式为_______。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______。
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
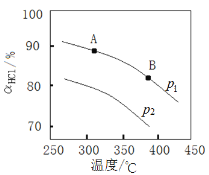
ⅰ.平衡常数比较:K(A)_____K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______。
【答案】![]() MnO2 + 4HCl(浓)===MnCl2+ Cl2↑+ 2H2O(反应条件为加热) 2Cl- -2e- === Cl2↑ 2CuCl2(s) + O2(g) === 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1 溶液由红色变为无色(或溶液红色变浅) 温度升高,反应速率加快,且氯化程度减少 > > 一定条件下,–1价Cl被氧化生成Cl2
MnO2 + 4HCl(浓)===MnCl2+ Cl2↑+ 2H2O(反应条件为加热) 2Cl- -2e- === Cl2↑ 2CuCl2(s) + O2(g) === 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1 溶液由红色变为无色(或溶液红色变浅) 温度升高,反应速率加快,且氯化程度减少 > > 一定条件下,–1价Cl被氧化生成Cl2
【解析】
(1)次氯酸钠为离子化合物,由阴、阳离子组成;
(2)MnO2和浓盐酸反应生成氯化锰、氯气和水;
(3)阳极上阴离子失去电子发生氧化反应;
(4)由盖斯定律得出热化学方程式;
(5)从化合价的角度分析,都为–1价Cl被氧化生成Cl2。
(1)消毒液中有效成分为次氯酸钠,次氯酸钠为离子化合物,电子式应为![]() ,故答案为:
,故答案为: ![]() 。
。
(2)MnO2和浓盐酸反应生成氯化锰、氯气和水,反应的化学方程式是MnO2 + 4HCl(浓)=MnCl2+ Cl2↑+ 2H2O(反应条件为加热),故答案为:MnO2 + 4HCl(浓)=MnCl2+ Cl2↑+ 2H2O(反应条件为加热)。
(3)电解饱和食盐水制取Cl2,阳极为氯离子放电生成氯气,电极方程式为:2Cl- -2e- = Cl2↑,故答案为:2Cl- -2e- = Cl2↑。
(4)①已知热化学方程式:①4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H=-115.4 kJmol-1 ②2HCl(g) + CuO (s)
2Cl2(g) + 2H2O(g) H=-115.4 kJmol-1 ②2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1 ,根据盖斯定律①-②×2可得过程II的热化学方程式为2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1,故答案为:2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1。
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1 ,根据盖斯定律①-②×2可得过程II的热化学方程式为2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1,故答案为:2CuCl2(s) + O2(g) = 2CuO (s)+ 2Cl2(g) H2= +125.4 kJmol-1。
②由信息可知,氯化初期流出的主要为不含HCl的气体,当氯化结束时,会有过量的氯化氢逸出,氯化氢可中和氢氧化钠溶液,使溶液的红色消失或变浅,故答案为:溶液由红色变为无色(或溶液红色变浅)。
③温度升高,反应速率加快,同时过程I逆向移动,氯化程度减少,所以氯化结束的时间缩短,故答案为:温度升高,反应速率加快,且氯化程度减少。
④ⅰ.由图可知,A点到B点温度升高,氯化氢的平衡转化率减小,平衡逆向移动,平衡常数减小,即K(A) > K(B) ,故答案为:>。
ⅱ.由化学方程式可知,该反应是气体体积减小的反应,增大压强,平衡正向移动,氯化氢的平衡转化率增大,由图可知,温度相同时,p1的氯化氢的平衡转化率大于p2的氯化氢的平衡转化率,故压强p1> p2,故答案为:>。
(5)以上三种制取Cl2的原理,其共同之处是一定条件下,–1价Cl被氧化生成Cl2,故答案为:一定条件下,–1价Cl被氧化生成Cl2。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
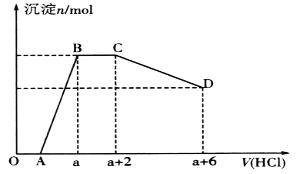
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是
实验 序号 | c(盐酸)/ (mol·L-1) | c(MOH)/ (mol·L-1) | 反应后溶 液的pH |
甲 | 0.20 | 0.20 | 5 |
乙 | 0.10 | a | 7 |
A. 由实验甲可判断出MOH为弱碱 B. 将实验甲中所得溶液加水稀释后,c(H+)/c(M+)变小
C. a>0.10 D. MOH的电离平衡常数可以表示为Kb=10-8/(a-0.10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
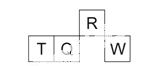
A. 最简单气态氢化物的热稳定性:R > Q
B. 最高价氧化物对应水化物的酸性:Q < W
C. 原子半径:T > Q > R
D. 含 T 的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 分子式为C8H8O2的芳香族化合物中属于羧酸的同分异构体有3种
B. 麦芽糖的水解产物有两种,且互为同分异构体
C. 等质量的苯和苯乙烯(![]() )完全燃烧,消耗氧气的体积相同
)完全燃烧,消耗氧气的体积相同
D. 分子式为C4H8Cl2且含有两个甲基的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 | A | B | C | D |
被提纯的物质 | 水(煤油) | 氯乙烷(水) | 甲苯(水) | 乙醇(乙酸) |
除杂试剂 | — | NaOH溶液 | — | NaOH溶液 |
分离方法 | 分液 | 蒸馏 | 过滤 | 分液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 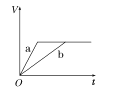 B.
B. 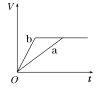 C.
C. 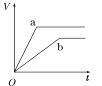 D.
D. 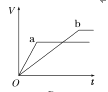
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,试回答以下问题:
Ⅰ.实验室用以下装置进行实验
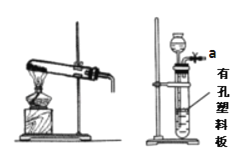
甲 乙
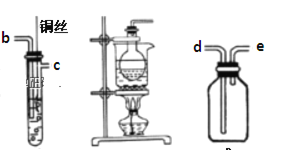
丙 丁 戊
(1)装置甲和戊用于制取并收集少量氨气,甲中发生反应的化学方程式为:_________。 戊装置收集氨气应从收集装置的_________(填字母序号)导管进气。
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中 盛满稀NaOH溶液,仪器正确的连接顺序为_________ (用接口字母表示)。
Ⅱ 无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。如图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
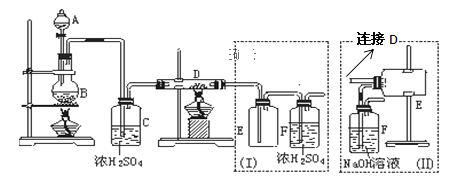
(3)B中反应的化学方程式为_______________________;其中浓盐酸表现出______性。
(4)D中的反应开始前,需进行的操作是_______________,应采取的方法是______________________。
(5)D中发生反应的化学方程式为_____________________________________________。
(6)装置(Ⅰ)的主要缺点是_________________________________________。
(7)装置(Ⅱ)中F中发生反应的化学方程式为___________________。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com