
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
分析 A.阳离子核外电子数=原子序数-电荷数,阴离子核外电子数=原子序数+电荷数;
B.元素的最高价氧化物的水化物酸性越强,其非金属性越强;
C.在金属和非金属性元素的交界处的单质能作半导体材料;
D.非金属性越强,气态氢化物的稳定性越强.
解答 解:A.aX2+的核外电子数为a-2,bY-的核外电子数为b+1,由核外电子层结构相同可知a-2=b+1,则a=b+3,故A正确;
B.HCl和HF不是最高价含氧酸,所以不能据此判断非金属性强弱,故B错误;
C.锗与硅位于金属与非金属的交界处,都可以做半导体材料,故C正确;
D.同一主族元素中从上到下,元素的非金属性逐渐减弱,S的非金属性比Se强,则氢化物稳定性:H2S>H2Se,故D正确;
故选B.
点评 本题考查周期表和周期律的应用,为高频考点,侧重于分析与应用能力的考查,把握元素的位置和性质、元素周期律等为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
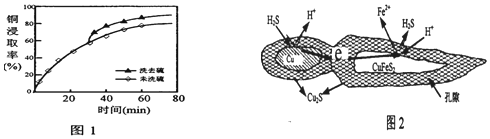
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
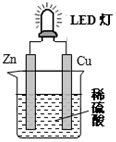
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
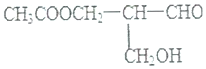
| A. | 与NaOH溶液共热 | B. | 与甲酸发生酯化反应 | ||
| C. | 与碱性Cu(OH)2悬浊液反应 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内H2O(g)、CO、H2物质的量相等 | B. | 容器内气体的密度不再改变 | ||
| C. | 生成n mol CO的同时生成n mol H2 | D. | v正(H2O)=v正(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
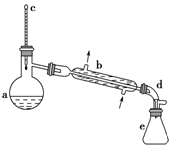 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: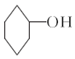 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$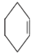 +H2O,
+H2O,| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 ,生成该物质的反应类型是取代反应
,生成该物质的反应类型是取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com