
【题目】溶液 X 中可能含有 Ba2+、NH4+、Na+、K+、Cl-、HCO3-、HSO3-、SO42-中的几种离子,各离子的浓度均相等。为了确定其组成,某同学进行了如图所示的实验,下列说法正确的是
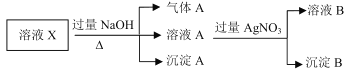
A.溶液 X中 Ba2+、NH4+、HCO3-、HSO3-一定存在
B.溶液 X中一定不存在SO42-、可能含有Cl-
C.是否存在Na+和K+需通过焰色反应进一步确认
D.沉淀A一定是BaCO3,沉淀B一定是AgCl
【答案】A
【解析】
X与过量NaOH反应生成气体A为NH3,沉淀A应为BaSO3或BaCO3或二者都存在,则溶液中一定含Ba2+、NH4+,HSO3-、HCO3-至少有一种,Ba2+、SO42-会形成BaSO4沉淀,不能大量共存,则含有Ba2+就一定不含SO42-,溶液A与硝酸银反应生成沉淀B可能为Ag2O或AgCl,溶液B含硝酸钠,由于各离子的浓度均相等,由电荷守恒可知,应含阴离子为Cl-、HCO3-,不含Na+、K+,沉淀A成分为BaSO3和BaCO3,以此来解答。
综上所述可知:溶液中一定含有Ba2+、NH4+、HCO3-、HSO3-、Cl-,一定不含有SO42-、Na+、K+。
A.由上述分析可知,X中Ba2+、NH4+、HCO3-、HSO3-一定存在,A正确;
B.溶液X中一定不存在SO42-、一定含有Cl-,B错误;
C.由电荷守恒可知,不含Na+、K+,不需要进行焰色反应,C错误;
D.沉淀A应为BaSO3和BaCO3,由于NaOH过量,所以沉淀B含有Ag2O,原溶液中含有Cl-,则沉淀B中也一定含有AgCl,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:

已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
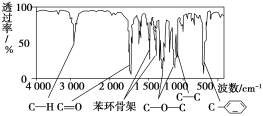
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属同一族,它们原子的最外层电子排布式为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是________。
(2)由这5种元素组成的一种化合物是(写化学式)______________________。写出该物质的一种主要用途:_________________________________________
(3)写出C元素基态原子的电子排布式:_______________________________。
(4)用电子排布图表示D元素原子的最外层电子排布:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物说法不正确的是
A.CH3CH(OH)CH2COOH系统命名法命名:3-羟基丁酸
B.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
C.四苯基乙烯(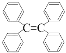 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
D.1mol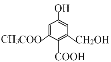 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3mol、4mol、1mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3mol、4mol、1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验利用苯甲酸(沸点249℃)和异丙醇(沸点82℃)制备苯甲酸异丙酯(沸点218℃),实验装置如图:
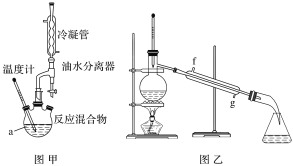
实验步骤:①在图甲干燥的仪器a中加入反应物苯甲酸、异丙醇和催化剂浓硫酸,再加入几粒沸石;②加热至70 ℃左右,保持恒温半小时;③将仪器a中反应后的液体用图乙所示装置进行精制得到产品。下列说法不正确的是
A.在仪器a中加入三种试剂的先后顺序是:浓硫酸、异丙醇、苯甲酸
B.加入的苯甲酸和异丙醇中,需过量的是苯甲酸
C.实验采用水浴加热,若温度过高会使产率减小
D.步骤③操作时应收集218 ℃的馏分,如果温度计水银球偏下,则收集的精制产品中可能混有的杂质为异丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞的形成主要源于石灰岩受地下水的长期溶蚀,发生反应:CaCO3+CO2+H2O=Ca(HCO3)2。当受热或压强突然减小时溶解的Ca(HCO3)2会分解,从而形成钟乳石、石笋等奇妙景观。
(1)写出Ca(HCO3)2受热分解的离子方程式____;从平衡移动的角度解释压强减小时Ca(HCO3)2分解的原因_______。
(2)向Ca(HCO3)2饱和溶液中滴加酚酞,溶液呈很浅的红色。由此可得到的结论是:饱和溶液中Ca(HCO3)2水解程度__________且___________。
(3)常温下,H2CO3的电离常数Ka2=4.7×10-11。若测得5.0×10-3 mol/L Ca(HCO3)2溶液的pH为8.0,则溶液中c(CO32-)与c(OH-)的比值为___________(简要写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com