
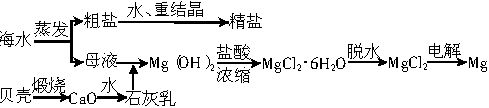
 等杂质,精制后可得到NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后加入盐酸至溶液呈中性。请写出各步可能发生的反应的离子方程式:___________
等杂质,精制后可得到NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后加入盐酸至溶液呈中性。请写出各步可能发生的反应的离子方程式:___________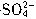 =BaSO4↓,2OH-+Mg2+=Mg(OH)2↓,
=BaSO4↓,2OH-+Mg2+=Mg(OH)2↓,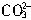 +Ca2+=CaCO3↓,
+Ca2+=CaCO3↓,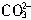 +Ba2+=BaCO3↓, H++
+Ba2+=BaCO3↓, H++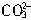 =
=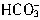 ,H++
,H++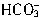 =H2O+CO2↑。
=H2O+CO2↑。 Mg(OH)Cl+HCl↑+5H2O↑或MgCl2?6H2O
Mg(OH)Cl+HCl↑+5H2O↑或MgCl2?6H2O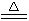 MgO+2HCl↑+5H2O↑
MgO+2HCl↑+5H2O↑

科目:高中化学 来源: 题型:

| ||
| ||
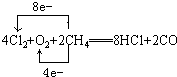
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
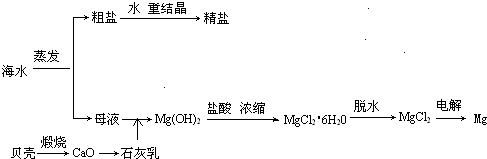
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:

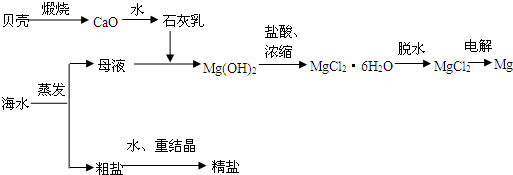
(1)在空气中加热MgCl2·6H2O,假设能生成MgO和HCl,写出相应的反应的化学方程式:____________________________________________________________________。
制取金属镁时,可以用电解MgCl2的方法,写出相应的反应的化学方程式:________________________________________。
(2)电解无水氯化镁产物之一的Cl2可与空气、甲烷起反应(产物为HCl、CO),再制得盐酸循环使用,写出该反应的化学方程式并标出电子转移的方向和数目:
____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com