


科目:高中化学 来源: 题型:阅读理解
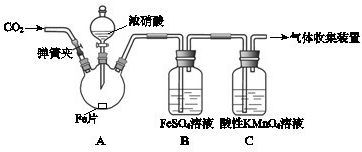
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
A.用托盘天平称取16.85 g KClO3固体
B.过滤时,为了加快过滤速率,用玻璃棒不断搅拌
C.给试管中滴加液体时,滴管应竖直在试管口的正上方
D.用100 mL量筒量取92.18 mL稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或记录数据正确的是( )
A.用托盘天平称取16.85 g KClO3固体
B.过滤时,为了加快过滤速率,用玻璃棒不断搅拌
C.给试管中滴加液体时,滴管应竖直在试管口的正上方
D.用100 mL量筒量取92.18 mL稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com