
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列叙述正确的是( )
A.6.8g熔融的KHSO4中含有0.05NA个阴离子
B.1.0L 1mol/L的NaOH水溶液中含有的氧原子数目为2 NA
C.25 ℃时,pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子
D.5.6g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示。在反应过程中导致速率变化的因素有________(填序号):
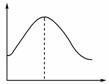
①H+的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应,Mg在空气中可以点燃,Fe在空气中不能点燃,是由于__________________的影响。
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于______的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:2SO2+O22SO3在一定条件下的密闭容器中进行。已知反应的某一时间SO2、O2、SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当达到平衡时,可能存在的数据为( )
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.25 mol·L-1
D.SO3为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
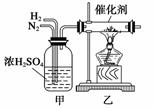
实验室合成氨的装置如下图所示。试回答:装置甲的作用:
①________________,②________________,
③____________________;从乙处导出的气体
是____________________;检验产物的最简单
的化学方法是_________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中,正确的是( )
A.Na2CO3溶液与Ba(OH)2溶液反应:
CO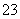 +Ba2+===BaCO3↓
+Ba2+===BaCO3↓
B.NaOH溶液与Ca(HCO3)2溶液反应:
HCO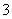 +OH-===CO
+OH-===CO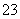 +H2O
+H2O
C.NaHCO3溶液与盐酸反应:
CO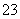 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D.NaHCO3溶液与CaCl2溶液反应:
CO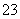 +Ca2+===CaCO3↓
+Ca2+===CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,弱酸的电离平衡常数如表所示,下列离子反应方程式错误的是
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | 5.61×10-11 |
A.氯水中加入少量NaHCO3粉末:HCO3- + H+ = H2O+CO2↑
B.NaAl(OH)4溶液中通入足量的CO2:Al(OH)4-+CO2 =Al(OH)3↓+ HCO3-
C.NaClO溶液中通入少量CO2:2ClO- +H2O+CO2 = CO32- + 2HClO
D.Na2CO3溶液中通入少量SO2:2 CO32-+ H2O+ SO2 = SO32-+2HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com