
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
分析 A.光照条件下,氯气和甲苯侧链上氢原子发生取代反应,在催化剂作用下,氯气和甲苯苯环H原子发生取代反应;
B.强酸能和弱酸盐反应生成弱酸;
C.乙烷和丙烯的每个分子中都含有6个H原子,根据H原子守恒判断生成水的物质的量;
D.2,2-二甲基丙烷只有一种氢原子,有几种氢原子,其一溴代物就有几种.
解答 解:A.光照条件下,氯气和甲苯侧链上氢原子发生取代反应,在催化剂作用下,氯气和甲苯苯环H原子发生取代反应,所以一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应,故A正确;
B.强酸能和弱酸盐反应生成弱酸,苯酚钠溶液中通入CO2 生成苯酚,说明碳酸的酸性比苯酚强,故B错误;
C.乙烷和丙烯的每个分子中都含有6个H原子,根据H原子守得,1 mol乙烷和丙烯混合物,完全燃烧生成3 mol H2O,故C正确;
D.2,2-二甲基丙烷只有一种氢原子,有几种氢原子,其一溴代物就有几种,所以光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种,故D正确;
故选B.
点评 本题考查同分异构体种类判断、酸性强弱比较、根据方程式进行计算等知识点,综合性较强,注意反应条件不同其产物可能不同,易错选项是C,利用原子守恒解答即可,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H2、C2H4 | B. | C6H6,C6H6O | C. | C3H8,C3H6 | D. | CH2O、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随物质变化和能量变化 | |
| B. | 元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 | |
| C. | 有些放热反应也需要加热才能发生 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
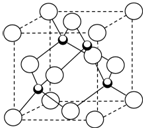 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
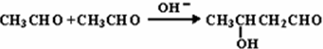
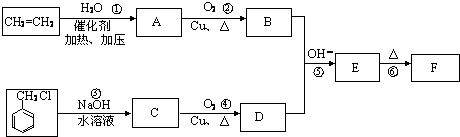
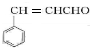 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com