
分析 根据盖斯定律,将热化学方程式①+②可得反应2Fe2O3(s)+3C(s)$\frac{\underline{\;\;△\;\;}}{\;}$4Fe(s)+3CO2(g),据此计算出该反应的△H即可.
解答 解:已知:①Fe2O3(s)+3C(s)$\frac{\underline{\;\;△\;\;}}{\;}$2Fe(s)+3CO(g)△H=-492.7kJ•mol-1
②3CO(g)+Fe2O3(s)$\frac{\underline{\;\;△\;\;}}{\;}$2Fe(s)+3CO2(g)△H=+25.2kJ•mol-1,
根据盖斯定律,将热化学方程式①+②可得反应2Fe2O3(s)+3C(s)$\frac{\underline{\;\;△\;\;}}{\;}$4Fe(s)+3CO2(g)△H=(-492.7kJ•mol-1)+(+25.2kJ•mol-1)=-467.5kJ•mol-1,
故答案为:-467.5.
点评 本题考查了盖斯定律在热化学方程式计算中的应用,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
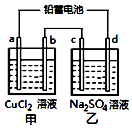 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫黄固体分别完全燃烧,前者放出的热量多 | |
| B. | a℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-2c kJ•mol-1 | |
| C. | 由N2O 4(g)?2NO2(g)△H=-56.9 kJ•mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ | |
| D. | 稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ•mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol HCl所具有的总能量高于1 mol H2所具有的总能量 | |
| B. | 1 mol H2和1 mol Cl2所具有的总能量高于2 mol HCl所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
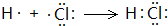 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾有可能产生丁达尔现象 | |
| B. | “PM2.5”没有必要纳入空气质量评价指标 | |
| C. | 近年来雾霾的形成与工业排放的烟气有关系 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com