
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
| Q |
| n |
| 1.421kJ |
| 0.025mol |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 物质 | 0℃ | 50℃ | 80℃ |
| Ca(0H)2 | 0.173 | 0.130 | 0.004 |
| Ba(OH)2 | 1.64 | 13.1 | 101.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
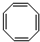 )分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
)分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).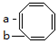
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
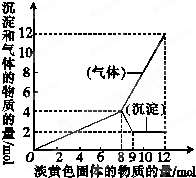 (1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.
(1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气象环境报告中新增的“PM2.5”是对一种新分子的描述 |
| B、“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关 |
| C、小苏打是制作面包等糕点的膨松剂,苏打是治疗胃酸过多的一种药剂 |
| D、乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何化合物既有氧化性又有还原性 |
| B、金属单质只有还原性,非金属单质只有氧化性 |
| C、根据氯气与水的反应可推出氧化性:Cl2强于HClO |
| D、硫与KOH溶液反应,被氧化的硫与被还原的硫物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com