
分析 (1)先根据方程式判断氢气和氧气的体积之比,从而计算出氢气和氧气的体积以及物质的量,根据氧气的体积计算氧气的质量,再利用平均摩尔质量法计算普通氢和重氢的物质的量之比,结合分子构成计算普通氢和重氢的原子个数之比即可;
(2)每个H2O含有10个质子、8个中子,每个D2O分子含有10个质子、10个质子,据此计算质子数、中子数之比;
(3)根据n=$\frac{m}{M}$计算质量相同的H2O和D2O的物质的量之比,然后根据m=nM,求出质量之比.
解答 解:(1)电解水的方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,
即氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的质量=$\frac{11.2L}{22.4L/mol}$×32g/mol=16g;
氢气的质量为2.5g,所以氢气的平均摩尔质量=$\frac{2.5g}{1mol}$=2.5g/mol,普通氢和重氢的物质的量之比为: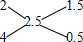 1.5:0.5=3:1,
1.5:0.5=3:1,
普通氢和重氢都是双原子分子,所以重氢和普通氢的原子个数比为1:3,故答案为:1:3;
(2)每个H2O含有10个质子、8个中子,每个D2O分子含有10个质子、10个质子,所以普通水和重水所含的质子数之比为3:1,而中子数之比为3×8:1×10=12:5,故答案为:3:1;12:5;
(3)根据n=$\frac{m}{M}$可知,质量相同的H2O和D2O的物质的量之比=20g/mol:18g/mol=10:9,二者分别与足量的金属钠反应生成气体的物质的量之比为10:9,所以气体的质量为:10×2:9×4=5:9,故答案为:5:9.
点评 本题考查物质的量有关计算,注意对公式的理解与灵活应用,有利于基础知识的巩固.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (SCN)2+2Br-→Br2+2SCN- | |
| B. | (SCN)2+H2S→2H++2SCN-+S↓ | |
| C. | 4H++2SCN-+MnO2 $\stackrel{△}{→}$Mn2++(SCN)2↑+2H2O | |
| D. | (SCN)2+2I-→2SCN-+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式C2H4 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式 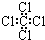 | D. | 环己烷的键线式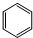 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了除去NaCl溶液中的MgCl2,可加氢氧化钠溶液至溶液呈中性 | |
| B. | 稀释浓硫酸时,将水沿烧杯内壁注入浓硫酸中,并用玻璃棒不断搅拌 | |
| C. | 某试样与NaOH浓溶液共热,产生使湿润红色石蕊试纸变蓝的气体,则试样中含有NH4+ | |
| D. | 做完实验后,剩余的金属钠应放回试剂瓶以消除安全隐患 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na Mg Al还原性依次减弱 | B. | I2 Br2 Cl2氧化性依次增强 | ||
| C. | C N O 原子半径依次增大 | D. | P S Cl 最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
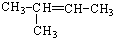 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色逐渐变浅 | |
| B. | 气态氢化物的稳定性逐渐增强 | |
| C. | 从F→I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 单质的熔沸点逐渐降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com