
分析 (1)反应中亚硝酸根离子氮元素化合价变化:+3→+2,碘离子中碘元素化合价变化:-1→0,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(2)能使NaNO2转化为不引起污染的N2,物质应具有还原性,依据题意判断产物,写出反应方程式;
(3)依据方程式可知2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,有16mol氯化氢参加反应,其中有10mol氯化氢中-1价的氯元素化合价升高被氧化生成氯气,所以每生成5mol氯气被氧化的氯化氢的物质的量为10mol,转移10mol电子,据此解答.
解答 解:(1)反应中亚硝酸根离子氮元素化合价变化:+3→+2,碘离子中碘元素化合价变化:-1→0,要使化合价升降数目相等,则亚硝酸根离子系数为2,碘离子系数为2,依据原子个数守恒,反应的方程式:2NO2-+2I-+4H+=2NO+I2+2H2O;
故答案为:2;2;4;2;1;2;
(2)因NaNO2转化为不引起污染的N2的过程中N的化合价降低,另一物质化合价必升高,物质具有还原性,只有NH4Cl符合,亚硝酸根离子与铵根离子发生归中反应生成氮气和水,离子方程式:NO2-+NH4+=N2+2H2O;
故答案为:C;NO2-+NH4+=N2+2H2O;
(3)依据方程式可知2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,有16mol氯化氢参加反应,其中有10mol氯化氢中-1价的氯元素化合价升高被氧化生成氯气,所以每生成5mol氯气被氧化的氯化氢的物质的量为10mol,转移10mol电子,则若生成 71gCl2,其物质的量为1mol,则被氧化的氯化氢的物质的量为2mol,质量m=2mol×36.5g/mol=73g;转移电子数目为2mol,个数为2NA;
故答案为:73; 2NA(或 1.204×1024).
点评 本题考查了氧化还原反应方程式的配平及有关方程式的计算,明确氧化还原反应得失电子守恒规律是解题关键,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O-+CO32-═H2CO3+2HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
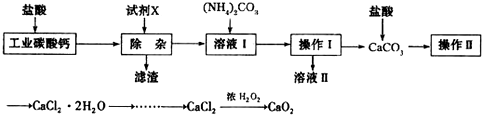
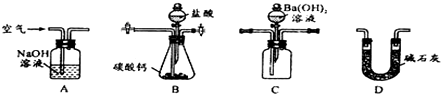
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L的AlCl3 | B. | 75mL 2mol/L的Al(NO3)3 | ||
| C. | 50mL 3mol/L的AlCl3 | D. | 50mL 3mol/L的AlBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
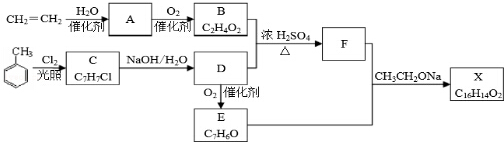
 .
. .
. B.
B. 
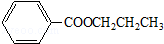
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 石灰水中加入少量小苏打:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com