

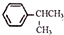
 可写成
可写成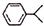
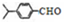 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;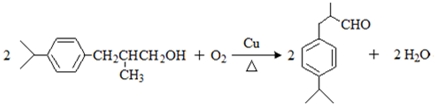 .
.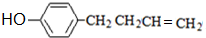 .
.分析 根据题给信息①知,A发生的反应①为加成反应,则A的结构简式为 ,②反应为消去反应,则B结构简式为
,②反应为消去反应,则B结构简式为 ,B发生加成反应生成C,C为
,B发生加成反应生成C,C为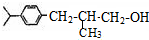 ,C氧化生成生成香料,据此分析解答.
,C氧化生成生成香料,据此分析解答.
解答 解:根据题给信息①知,A发生的反应①为加成反应,则A的结构简式为 ,②反应为消去反应,则B结构简式为
,②反应为消去反应,则B结构简式为 ,B发生加成反应生成C,C为
,B发生加成反应生成C,C为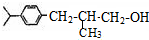 ,C氧化生成生成香料,
,C氧化生成生成香料,
(1)A的结构简式是 ,上述合成路线中①属于加成反应,
,上述合成路线中①属于加成反应,
故答案为: ;加成;
;加成;
(2)CH3CH(OH)CH2CHO的化学名称为3-甲基丁醛,在铜作催化剂、加热条件下,C被氧化生成香料,反应方程式为: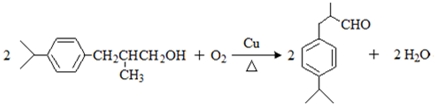 ,
,
故答案为:3-羟基丁醛;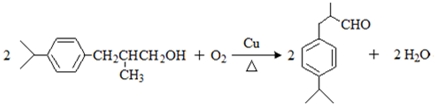 ;
;
(3)A的结构简式是 ,A的同分异构体符合以下条件:
,A的同分异构体符合以下条件:
①遇FeCl3溶液显色说明含有酚羟基;
②能发生加聚反应说明含有不饱和键;
③苯环上只有两个互为对位的取代基,则为-OH、另一为丁烯形成的烯烃基,
CH2=CHCH2CH3有4种H原子,故有4种烃基;CH3CH=CHCH3有2种H原子,故有2种烃基;CH2=C(CH3)CH3有2种H原子,故有2种烃基,故有8种丁烯基,有8种同分异构体,
其中有一种同分异构体中不含甲基,其结构简式为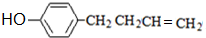 ,
,
故答案为:8;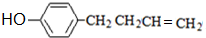 ;
;
(4)B结构简式为 ,
,
a.B不属于蛋白质,所以遇浓硝酸不显黄色,故错误;
b.B中含有醛基,所以可发生银镜反应,故正确;
c.碳碳双键、醛基和苯环能和氢气发生加成反应,1mol该物质最多能与5molH2反应,故正确;
d.含有碳碳双键,所以一定条件下能生成高聚物,故正确;
故选bcd.
点评 本题考查有机物推断,为高考高频点,根据反应条件、物质的结构简式结合题给信息进行推断,熟悉常见有机反应类型及反应条件,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI比AgCl更难溶于水,所以AgCl易转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
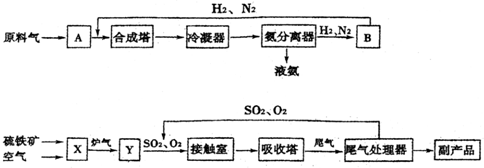
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
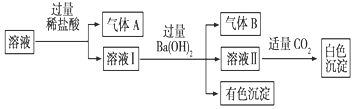
| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+离子 | |
| D. | 溶液中一定不存在大量Na+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 将1mol氯气通入足量水中发生反应转移电子数为 NA | |
| C. | 585 g氯化钠晶体中约含有6.02×1022个氯化钠分子 | |
| D. | 常温下,200 ml、0.5 mol•L-1的Na2CO3溶液中阴离子数目等于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
| B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
| C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
| D | 在分液漏斗中加入碘水后再加入苯,充分振荡 | 分层,且上层溶液呈紫色 | 苯可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com