
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
分析 (1)电离平衡常数越大,酸的电离程度越大,溶液酸性越强,则电解质越强;
(2)设出该醋酸的电离度,然后根据该稳定性醋酸的电离平衡常数列式计算;酸性越弱,稀释后溶液的pH变化越大;
(3)酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱;
(4)亚硫酸氢钠是强碱弱酸盐,溶液显酸性,说明亚硫酸氢根离子电离程度大于其水解程度.
解答 解:(1)根据表中数据可知,酸的电离平衡常数大小为:H2SO3>CH3COOH>H2CO3>HSO3->HCO3-,电离平衡常数越大,酸性越强,所以电解质由强到弱的顺序为为:H2SO3>CH3COOH>H2CO3,
故答案为:H2SO3>CH3COOH>H2CO3;
(2)0.02mol/L的醋酸在溶液中存在电离平衡:CH3COOH?CH3COO-+H+,设该溶液中醋酸的电离度为x,则醋酸电离出的醋酸根离子、氢离子浓度为0.02xmol/L,醋酸的浓度为0.02(1-x)mol/L,根据醋酸的电离平衡常数K=1.8×10-5可知:K=1.8×10-5=$\frac{0.02x×0.02x}{0.02×(1-x)}$,解得:x=3%;
由于醋酸的酸性需小于亚硫酸,pH相同的醋酸和亚硫酸稀释相同倍数后,亚硫酸的pH变化大,即:醋酸的pH小于亚硫酸,
故答案为:3%;<;
(3)已知酸性:H2SO3>CH3COOH>H2CO3>HSO3->HCO3-,酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为:CO32->SO32->CH3COO->HSO3-,
故答案为:CO32->SO32->CH3COO->HSO3-;
(4)NaHSO3水溶液中存在电离平衡和水解平衡HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,溶液显酸性说明HSO3-的电离程度大于水解程度,溶液中离子浓度大小关系为:C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-);
故答案为:HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性;C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-).
点评 本题考查了弱电解质在溶液中的电离平衡、盐的水解原理的应用、离子浓度大小比较,题目难度中等,明确弱电解质的电离平衡的影响因素为解答关键,注意掌握判断电解质强弱、电离常数的概念及计算方法,试题培养了学生的灵活应用能力.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4 NH4+ | |
| B. | 澄清石灰水与小苏打溶液混合:Ca2++CO32-=CaCO3↓ | |
| C. | Na[Al(OH)4]溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测溶液中SO42-,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO3-、SO32-等离子干扰 |
| B | 铝箔插入稀硝酸中 | 铝箔表面被HNO3氧化形成致密的氧化膜 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2而不是MgCO3 | Kap(MgCO3)<Kap[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | Na2SO3溶液中c(H+)<c (OH-) | |
| B. | Na2SO3溶液中c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)>c(H+) | |
| C. | 当吸收液呈中性时,c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)=c(H+) | |
| D. | 当吸收液呈中性时,c(Na+)>c (HSO3-)+c (SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H=a kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 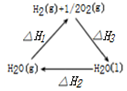 图表示:△H1=△H2+△H3 | |
| B. | 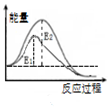 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 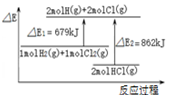 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 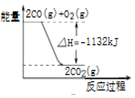 图表示:CO的燃烧热为1132KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com