
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
分析 A.碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
B.1个甲基(-14CH3)所含电子数为:9;
C.气体摩尔体积使用对象为气体;
D.依据氯原子个数守恒计算.
解答 解:A.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,所以1L 0.1mol/L的Na2CO3溶液中,阴离子总数大于0.1NA,故A错误;
B.1个甲基(-14CH3)所含电子数为:9,则常温常压下,17 g甲基(-14CH3)物质的量为$\frac{17g}{17g/mol}$=1mol,所含的电子数为9NA,故B正确;
C.标况下甲醇为液体,不能使用气体摩尔体积,故C错误;
D.氯气溶于水,部分与水反应生成氯化氢和次氯酸,部分以氯气分子形式存在,所以将lmol Cl2通入水中,HClO、Cl-、ClO- 粒子数之和小于2NA,故D错误;
故选:B.
点评 本题考查了有关阿伏伽德罗常数的应用,注意掌握标况下的气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度之间的关系,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 酶属于碳水化合物,是生物体中重要的催化剂 | |
| B. | 纤维素为天然高分子化合物,遇碘水会变蓝色 | |
| C. | 某些卤代烃能破坏臭氧层,使卤代烃的使用受到限制 | |
| D. | 某有机物的1H核磁共振谱图中特征峰的数目就是氢原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置的能量转化方式为太阳能转化为电能 | |
| B. | 工作时,阳极附近pH减小 | |
| C. | 电路中每转移4mol电子,捕获44g二氧化碳 | |
| D. | 阴极的电极反应为CO2+2e-=CO+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Fe3+有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸有腐蚀性 | 常温下浓硫酸不能用铁罐盛装 |
| C | Cl2是非金属单质 | Cl2能使湿润的有色布条褪色 |
| D | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式 C2H4O2 | B. | 氯化钠的电子式: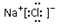 | ||
| C. | 硫原子的原子结构示意图: | D. | 水的电离方程式 2H2O═H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2, | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-=MgCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都能发生水解反应 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 苯不能使溴的四氯化碳溶液褪色,但能与H2发生加成反应 | |
| D. | 因分子中均含有官能团“-OH”,故乙醇、乙酸水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| B. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| C. | 冰与干冰都是分子晶体,其晶胞中分子的空间排列方式类似 | |
| D. | 水分子间通过H-O键形成冰晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com