
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
分析 (1)实验①和②中除了温度不同,其它条件完全相同,则探究的是温度对反应速率的影响;
(2)锌与盐酸反应生成氯化锌和氢气,据此写出反应的离子方程式;
(3)实验实验②和③中盐酸的浓度不同,且实验③的浓度较大,收集等体积的氢气消耗时间短;
(4)影响化学反应速率的因素,除温度、浓度外,催化剂及固体颗粒大小也影响化学反应速率;
(5)反应都生成+2价金属离子,金属的摩尔质量越大,等质量时物质的量越小,则生成气体越少.
解答 解:(1)根据实验①和②的数据可知,除温度不同,其它条件完全相同,则实验目的是探究温度对反应速率的影响,
故答案为:温度对反应速率的影响;
(2)锌与盐酸反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(3)实验②和③中盐酸的浓度不同,收集100mL氢气消耗的时间较短,说明盐酸浓度越大,反应速率越快,
故答案为:盐酸浓度越大;
(4)除上述条件的改变引起速率的改变外,锌的颗粒大小也影响化学反应速率,如,锌粒与锌片与相同浓度的盐酸反应时,锌粒的反应速率较快,
故答案为:锌的颗粒大小;
(5)铁的摩尔质量为56g/mol,锌的摩尔质量为65g/mol,根据n=$\frac{m}{M}$可知,相同质量的铁锌,铁的物质的量多,且反应后都生成+2价金属离子,则铁失电子多(每摩尔铁锌均失2mole-),产生的氢气多,
故答案为:铁产生的氢气多,铁的摩尔质量小于锌,相同质量的铁锌,铁的物质的量多,失电子多(每摩尔铁锌均失2mole-).
点评 本题考查了影响化学反应速率的因素,题目难度中等,明确影响化学反应速率的因素为解答关键,注意掌握探究实验的设计原则,试题知识点较多,充分考查学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
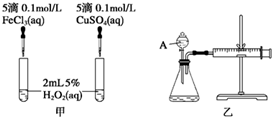
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO | C. | NO2 | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
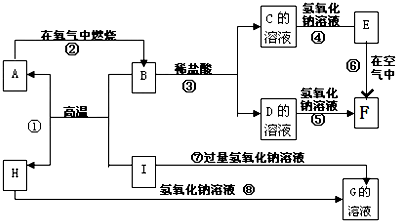
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
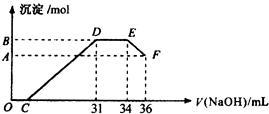 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com