
| A. | 原子晶体的熔点一定比金属晶体的高 | |
| B. | 分子晶体的熔点一定比金属晶体的低 | |
| C. | 晶体内部的微粒按一定规律周期性的排列 | |
| D. | 凡有规则外形的固体一定是晶体 |
分析 A.原子晶体的熔点不一定比金属晶体高;
B.分子晶体的熔点不一定比金属晶体低;
C.晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
D.晶体内部的微粒按一定规律作周期性重复排列,与其外形的规则性与否无关.
解答 解:A.一般来说,原子晶体的熔点大于金属晶体,而金属钨的熔点很高,则原子晶体的熔点不一定比金属晶体的高,故A错误;
B.金属晶体熔沸点差别很大,分子晶体的熔点不一定比金属晶体低,如Hg的熔点较低,故B错误;
C.晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,有自范性,故C正确;
D.晶体内部的微粒按一定规律作周期性重复排列,与其外形的规则性与否无关,有规则外形的物质不一定是晶体,故D错误;
故选C.
点评 本题考查晶体熔沸点高低判断、晶体概念等知识点,侧重考查学生分析判断、对概念的理解,采用举例法分析解答,注意规律中的特例,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 当x≤4时,均为气体(常温常压下) | |
| B. | y一定是偶数 | |
| C. | 分别燃烧1mol,耗氧气(x+$\frac{y}{4}$)mol | |
| D. | 在150℃时的密闭容器中完全燃烧后恢复到原温度,测得的压强一定比燃烧前增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
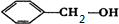 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可与钠反应 | |
| B. | 其同类同分异构体共4种 | |
| C. | 其同类同分异构体共6种(包括其本身) | |
| D. | 完全燃烧时耗氧的质量比本身的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
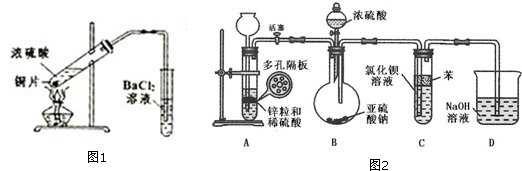
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com