
【题目】完成下列各题:
(1)铜与浓硝酸可发生反应:Cu+4HNO3(浓)═Cu(NO3)2 +2NO2↑+2H2O,其中铜被(填“氧化”或“还原”),浓硝酸作(填“氧化”或“还原”)剂.在该反应中,若消耗了1mol Cu,则生成mol NO2
(2)3.01×1023个氯气分子的物质的量是;1.5 mol Na2SO410H2O中所含的Na+的物质的量是 , 所含的SO42﹣的物质的量是 , 所含H2O的数目是NA
(3)4种物质:①NH3、②SO2、③NaCl溶液、④H2SO4溶液.其中,能使品红溶液褪色的是(填序号,下同),焰色反应呈黄色的是,遇氯化氢有白烟产生的是 , 与氯化钡溶液反应产生白色沉淀的是
(4)某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝.请回答: a.两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为、 . 向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失;另一种溶液中的现象是(填序号).
①产生白色沉淀
②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
b.铝与氧化铁的反应可用于焊接钢轨,其反应的化学方程式为 .
【答案】
(1)氧化;氧化;2
(2)0.5mol;3mol;1.5mol;15
(3)②;①;④
(4)FeCl3;AlCl3;②;2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】解:(1.)该反应中,铜元素化合价由0价变为+2价、N元素化合价由+5价变为+4价,所以硝酸是氧化剂、Cu是还原剂,还原剂被氧化,所以Cu被氧化,在该反应中,根据Cu和二氧化氮之间的关系式知,若消耗了1mol Cu,则生成2mol NO2 , 所以答案是:氧化;氧化;2;
(2.)3.01×1023个氯气分子的物质的量是 ![]() =0.5mol;Na2SO410H2O在水中电离方程式为:Na2SO410H2O=2Na++SO42﹣+10H2O,所以Na2SO410H2O中n(Na+)=2n(Na2SO410H2O)=2n(SO42﹣),则1.5mol Na2SO410H2O中所含的Na+的物质的量是3mol;所含的SO42﹣的物质的量是1.5mol;所含H2O的数目N(H2O)=10n(Na2SO410H2O)×NA=15NA ,
=0.5mol;Na2SO410H2O在水中电离方程式为:Na2SO410H2O=2Na++SO42﹣+10H2O,所以Na2SO410H2O中n(Na+)=2n(Na2SO410H2O)=2n(SO42﹣),则1.5mol Na2SO410H2O中所含的Na+的物质的量是3mol;所含的SO42﹣的物质的量是1.5mol;所含H2O的数目N(H2O)=10n(Na2SO410H2O)×NA=15NA ,
所以答案是:0.5mol;3mol;1.5mol;15;
(3.)SO2能够使品红溶液褪色,加热后又会恢复原色,故能使品红溶液褪色的是②;
钠元素焰色反应呈现黄色,所以焰色反应呈黄色的是③;
NH3 易挥发,遇到氯化氢后会生成氯化铵小颗粒,产生白烟现象,故遇氯化氢有白烟产生的是①;
四种物质中能够和氯化钡反应生成沉淀的是H2SO4 , 故四种物质中能够和氯化钡反应生成沉淀的是④,
所以答案是:②;③;①;④;
(4.)a、氧化铁和盐酸反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,氧化铝和盐酸反应方程式为:Al2O3+6HCl=2AlCl3+3H2O,所以二者得到的盐分别是FeCl3、AlCl3 , 向AlCl3溶液中滴加氢氧化钠,现象是先产生白色沉淀,然后白色沉淀逐渐消失;向氯化铁溶液中滴加氢氧化钠,氢氧化钠和氯化铁溶液反应,立即生成红褐色氢氧化铁沉淀,所以看到的现象是产生红褐色沉淀,故选②,
所以答案是:FeCl3;AlCl3;②;
b、铝和氧化铁发生铝热反应且放出大量热,从而用于焊接钢轨,反应方程式为:2Al+Fe2O3 ![]() 2Fe+Al2O3 , 所以答案是:2Al+Fe2O3
2Fe+Al2O3 , 所以答案是:2Al+Fe2O3 ![]() 2Fe+Al2O3 .
2Fe+Al2O3 .


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图所示。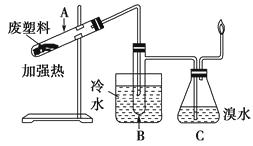
加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数/% | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物→聚乙炔
写出反应②③的化学方程式?
(2)B中收集得到的物质中能使酸性KMnO4溶液褪色的物质的一氯代物有种。
(3)锥形瓶C中观察到的现象是。经溴水充分吸收,剩余气体经干燥后平均相对分子质量为。
(4)写出C中逸出的气体在工业上的两种用途、。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是( )
A. 利用太阳能直接使水分解产生氢气
B. 以焦炭和水制取水煤气(含CO和H2)后分离出氢气
C. 用铁和盐酸反应放出氢气
D. 由热电站提供电力电解水产生氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清的石灰水变浑浊,另外测得这种气体密度为同温、同压下的氧气密度的1.375倍。B固体能溶于热苛性钠溶液,再往所得的溶液中加入过量盐酸时,析出白色胶状沉淀。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热后能得到C,C在高温时软化,无固定熔点。
根据以上事实,判断A为元素的单质,B的化学式为 , C物质为。
写出生成C的有关反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种很重要的铁盐,主要用于污水处理,且有效果好、价格便宜等优点.工业上可将铁粉溶于盐酸中,先生成FeCl2 , 再通入Cl2氧化来制备FeCl3溶液.
已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00molL﹣1 .
(1)在标准状况下,将44.8LHCl气体溶于100mL水中,所得溶液A的密度为1.038gcm﹣3 , 则溶液中HCl的物质的量浓度为;(若使饱和NaCl溶液中Cl﹣浓度与溶液A中的Cl﹣浓度相等,则还应溶解约L标准状况HCl气体(溶液体积变化忽略不计).
(2)若实验室需0.5molL﹣1NaCl溶液240mL,则应量取体积是mL的饱和NaCl溶液来配制,在配制过程
中,使用前必须检查是否漏液的仪器有;下列配制操作,造溶液浓度偏高的是(选填标号).
A.量取溶液时有少量液体溅出
B.容量瓶用蒸馏水洗涤干净后未干燥
C.定容时,俯视液面加水至刻度线
D.转移液体后,未用蒸馏水洗涤烧杯和玻璃棒
E.用量筒量取溶液时仰视读数
F.定容时不慎超过度线,立即用胶头滴管吸出多余部分
(3)FeCl3溶液可以用来净水,其净水的原理为(用离子方程式表示),若100mL、1molL﹣1的FeCl3溶液净水时,生成具有净水作用的微粒数0.1NA(填“大于”、“等于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的生产步骤有:①浓缩结晶 ②加熟石灰③加盐酸 ④过滤 ⑤熔融电解,正确的生产顺序是( )
A.①②③④⑤
B.⑤④③①②
C.②④③①⑤
D.③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过题图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.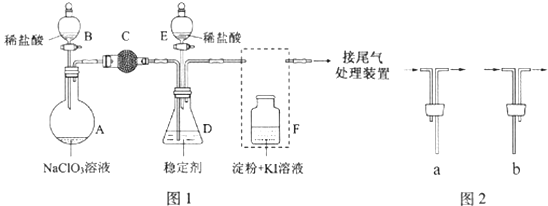
(1)仪器D的名称是 . 安装F中导管时,应选用图2中的 .
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2 , 此时F中溶液的颜色不变,则装置C的作用是 .
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为 , 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol任何气体所占体积都为22.4 L
B.1 mol H2O在标准状况下体积为22.4 L
C.1 mol气体体积为22.4 L,则一定是标准状况
D.气体摩尔体积不一定是22.4 L/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com