
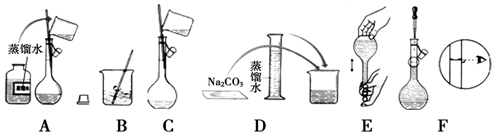
分析 (1)依据配制一定物质的量浓度溶液一般步骤判断需要的仪器;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,据此排序;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)晶体已经部分失去结晶水,导致称量的溶质碳酸钠的物质的量偏大,依据C=$\frac{n}{V}$进行误差分析;
(5)依据容量瓶使用方法及注意事项解答.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以缺少的仪器:100 mL容量瓶、胶头滴管;
故答案为:100 mL容量瓶;胶头滴管;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的操作顺序为:DBCAFE;
故答案为:DBCAFE;
(3)步骤A通常称为洗涤,如果没有步骤A,导致部分溶质损耗,溶质的物质的量偏小,则配得溶液的浓度将偏低;步骤F称为定容操作;如果俯视刻度线,导致溶液体积偏小,配得溶液的浓度将偏高;
故答案为:偏低;定容;偏高;
(4)用Na2CO3•10H2O来配制溶液,若晶体已经部分失去结晶水,称量的碳酸钠晶体中含有的碳酸钠的物质的量偏大,则所配得溶液的浓度会偏高,
故答案为:偏高;
(5)容量瓶标定容积为室温下的体积,因为液体的热胀冷缩,如果不是在标定温度下,测定的体积会出现偏差,所以溶解后移液前应进行冷却,待冷却到室温再移液;
故答案为:冷却至室温.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度不大,注意掌握正确的配制方法,本题中误差分析为难度,注意明确误差分析的方法及技巧.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
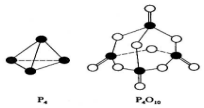 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |
查看答案和解析>>
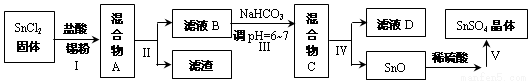
科目:高中化学 来源: 题型:解答题
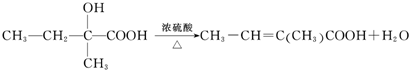 .
.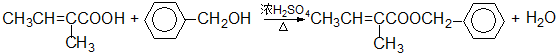 .
.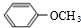 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
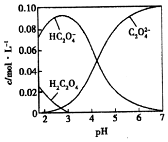 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x>0 a<0 | |
| B. | b<o c<o | |
| C. | x=3a-b-c | |
| D. | 1mol碳(s)在空气中不完全燃烧生成CO的焓变小与akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的容量瓶可以放进烘箱中烘干 | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口放出 | |
| D. | 用二硫化碳清洗残留在试管壁上少量的硫粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com