
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
分析 在水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐、活泼金属氧化物、水都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,非金属氧化物、一些氢化物、大多数的有机物(如蔗糖、乙醇等)都是非电解质;单质,混合物既不是电解质也不是非电解质.
解答 解:①氯化钠溶液能导电,但是属于混合物,既不是电解质也不是非电解质; ②氯化铵固体不能导电;③铜能导电,但是属于单质,既不是电解质也不是非电解质; ④BaSO4 不能导电,属于电解质;⑤熔融NaOH能导电,属于电解质;⑥稀硫酸能导电,但是属于混合物,既不是电解质也不是非电解质;⑦乙酸不能导电,溶于水能导电,属于弱电解质,故选B.
点评 本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质,离子晶体在固体时不导电.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶事先未烘干 | B. | 定容时观察液面仰视 | ||
| C. | 定容时观察液面俯视 | D. | 定容,摇匀后有少量液体流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
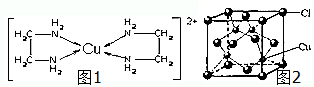 CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(n-2m)}{V}mol•{L^{-1}}$ | B. | $\frac{(n-m)}{V}mol•{L^{-1}}$ | C. | $\frac{(2n-2m)}{V}mol•{L^{-1}}$ | D. | $\frac{(2n-4m)}{V}mol•{L^{-1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②④⑤ | C. | ②③⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com