
【题目】ClO2是高效、广谱、绿色的消毒剂,回答下列问题。
(1)氯在元素周期表中的位置是_______________,1mol 37Cl的中子数为_______________。
(2)下列能判断Cl和O两种元素非金属性强弱的是____________ (填序号) 。
a.原子得电子能力 b.与金属钠反应得电子的数目c.气态氢化物的稳定性 d.单质的沸点
(3)生产生活中含氯物质的排放会加快臭氧层的破坏,其机理如图所示,该机理的总反应化学方程式为_______________。
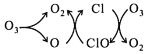
(4)化工、冶金行业的废水中存在CN—,可用ClO2气体将其转化为两种无毒气体
①CN—的电子式为_______________。
②该反应的离子方程式为_______________。
【答案】第三周期ⅤⅡA族 1.204×1025个 ac 2O3 ![]() 3O2或2O3
3O2或2O3![]() 3O2
3O2 ![]() 2CN+2ClO2=2CO2+N2+2Cl
2CN+2ClO2=2CO2+N2+2Cl
【解析】
(1)Cl的质子数为17,原子结构中含3个电子层、最外层电子数为7,37Cl的中子数为37-17=20;
(2)由得电子能力及气态氢化物的稳定性等来比较非金属性;
(3)由图可知O3转化为O2;
(4)①CN-中含C≡N;
②发生氧化还原反应生成氮气、二氧化碳和氯离子。
(1)氯在元素周期表中的位置是第三周期ⅤⅡA族;1mol37Cl的中子数为1mol×(37-17)×6.02×1023=1.204×1025个,
故答案为:第三周期ⅤⅡA族;1.204×1025个;
(2)由得电子能力及气态氢化物的稳定性等来比较非金属性,只有ac符合,与得电子多少、单质的沸点无关,
故答案为:ac;
(3)由图可知O3转化为O2,总反应化学方程式为2O3 ![]() 3O2或2O3
3O2或2O3![]() 3O2,
3O2,
故答案为:2O3 ![]() 3O2或2O3
3O2或2O3![]() 3O2;
3O2;
(4)①CN一中碳氮之间为三键,电子式为![]() 。
。
故答案为:![]() ;
;
②ClO2氧化性较强,是常用的氧化剂,其中+4价氯元素通常被还原为1价,在该反应中而CN中+2价碳元素通常被氧化成+4价,而氮元素则容易被氧化成0价形成氮气,由电子、电荷可知离子反应为2CN+2ClO2=2CO2+N2+2Cl,
故答案为:2CN+2ClO2=2CO2+N2+2Cl。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置能达到相应实验目的的是
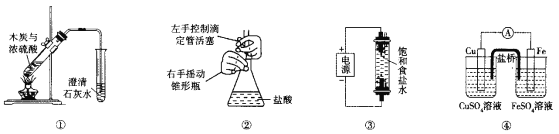
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________,一氧化碳的体积分数是__________,一氧化碳的质量分数是__________,碳原子和氧原子个数比是__________,混合气体的平均相对分子质量是__________,密度是__________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(任务一)探究墨粉中铁的氧化物。墨粉是由树脂和炭黑、电荷剂、磁粉(铁氧化物)等组成。
(1)向一定量墨粉中加入适量的稀硫酸充分振荡后,向试管中缓缓压入棉花团至试管底部,棉花团所起的作用是___________。
(2)取(1)中水层部分清液,把清液分装两试管,一试管中加入适量![]() 溶液,出现_________,证明有Fe3+,另一试管中加入铁氰化钾溶液,立即出现______,证明有Fe2+。
溶液,出现_________,证明有Fe3+,另一试管中加入铁氰化钾溶液,立即出现______,证明有Fe2+。
(任务二)设计实验方案,测定墨粉中铁元素的质量分数。取![]() 墨粉经过一系列操作,配制成
墨粉经过一系列操作,配制成![]() 溶液(溶液中铁元素全部转化为Fe3+),取出
溶液(溶液中铁元素全部转化为Fe3+),取出![]() 溶液,用
溶液,用![]() 的
的![]() 溶液滴定。
溶液滴定。
(1)滴定过程中,选择的指示剂是______。
a.淀粉溶液 b. ![]() 溶液 c.
溶液 c.![]() 溶液 d.
溶液 d.![]() 溶液
溶液
(2)若滴定过程中消耗![]() 溶液
溶液![]() ,则墨粉中铁的质量分数为______(百分数保留两位整数)。
,则墨粉中铁的质量分数为______(百分数保留两位整数)。
(任务三)了解![]() 的工业制备。复印机使用的墨粉的主要成分是
的工业制备。复印机使用的墨粉的主要成分是![]() ,如图是利用硫铁矿烧渣制备高纯
,如图是利用硫铁矿烧渣制备高纯![]() 的工艺流程。
的工艺流程。

已知:
①![]() ;
;
②![]() 在水中可溶,在乙醇中难溶;
在水中可溶,在乙醇中难溶;
③![]() 在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线如图所示:
在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线如图所示:

回答下列问题:
(1)①浸出液中含有的金属阳离子为______________,操作②中加入铁屑的目的是_________。
(2)步骤③用![]() 作氧化剂的优点是_______。
作氧化剂的优点是_______。
(3)经步骤⑤后,一般需要对所得晶体进行洗涤和干燥处理。请说出选择乙醇和水的混合液作为洗涤液的理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1<ΔH3 C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
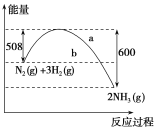
【题目】(1)如图是298K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为____。
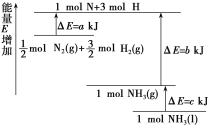
(2)化学反应N2+3H2![]() 2NH3的能量变化如图所示(假设该反应反应完全),试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:____。
2NH3的能量变化如图所示(假设该反应反应完全),试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁![]() ,是新型絮凝剂,可用来杀灭水中病菌
,是新型絮凝剂,可用来杀灭水中病菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________。
(2)![]() 有________几种不同的运动状态的电子,
有________几种不同的运动状态的电子,![]() 比
比![]() 更稳定的原因是_________。
更稳定的原因是_________。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________(用元素符号表示)。
(4)![]() 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体![]() 属于______晶体。
属于______晶体。![]() 的空间构型为_____。
的空间构型为_____。
(5) ![]() 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。![]() 分子中S的杂化方式为______。每个
分子中S的杂化方式为______。每个![]() 分子中含有的孤电子对的数目为_________。
分子中含有的孤电子对的数目为_________。


(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________。若该晶胞的边长为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则该氧化物的密度为_________
,则该氧化物的密度为_________![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com