
【题目】下列有关叙述中正确的是( )
A.等质量的CH4和CO2产生的温室效应是后者大
B.达到最强烈爆炸点时,CH4与O2的体积之比等于1:3
C.甲烷与氯气发生取代反应,其氯代产物与HCl分离可采用水洗法
D.甲烷为正四面体结构而不是平面四边形结构的事实是:CHCl3只有一种结构
科目:高中化学 来源: 题型:
【题目】右图是一种检验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
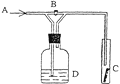
A.浓H2SO4 B.饱和食盐水C.浓NaOH溶液D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应![]() ,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比一定是1:2
C.达到平衡状态时A的物质的量为![]()
D.当![]() 时,可断定反应达到平衡状态
时,可断定反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置符合实验目的是( )
目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
装置 |
|
|
|
|
选项 | A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用凯氏定氮法(Kjeldahl method)来测定农产品中氮的含量,测定过程如下:
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。

回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为______________________________。
(2)盛放氢氧化钠溶液的仪器名称为__________________;玻璃管2的作用是___________________;圆底烧瓶中碎瓷片的作用是_________________________________________。
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为_______________________________。
②C装置冰水混合物的作用是__________________________________。
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择____________________。
a.甲基橙 b.配酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为_____________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
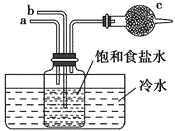
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | T ℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.00×10-5 |
(1)“酸浸”前将废料粉碎,其目的是____________________。
(2)调节pH步骤中,溶液pH的调节范围是________________。
(3)滤渣1主要成分的化学式是CaSO4和_____,滤渣3主要成分的化学式______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:_______________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1.0×10-5 mol/L],则需要加入Na2CO3(M=106 g/mol)固体的质量最少为_____g。
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 ________、________过滤、洗涤、干燥得到醋酸镍产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com