
| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
分析 二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,氨化的饱和氯化铵溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出,母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.循环利用;
解答 解:A.侯氏制碱法是将CO2通入含NH3的饱和NaCl溶液中,结晶,析出NaHCO3,过滤,将NaHCO3加热分解制得Na2CO3.主要原料是NaCl、CO2和NH3,故A正确;
B.碳酸氢钠受热分解,碳酸钠不分解,所以Na2CO3的热稳定性高于NaHCO3,故B错误;
C.氨化的饱和氯化铵溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出;在氨饱和NaCl溶液中通入CO2的两步反应方程式为:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl,副产物是NH4Cl,故C正确;
D.母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.可以循环使用,故D正确;
故选B.
点评 本题考查了纯碱工业制备原理分析比较,反应实质的应用,试剂的作用,理解生产原理和过程的实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 离子半径 | 第一电力能 | 熔点 | 酸性 |
| O2->Na+ | Si<S | NaCl<NaF | HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
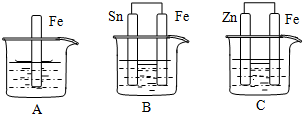
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
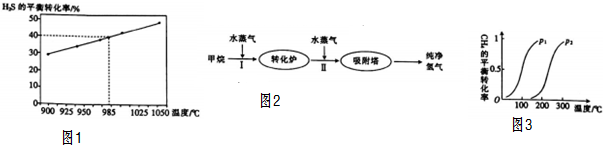
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
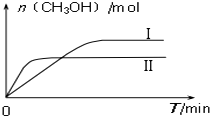 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3OOCCH3 乙酸甲酯 | ||
| C. |  硬酯酸甘油脂 硬酯酸甘油脂 | D. | 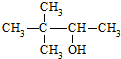 2,2二甲基-3-丁醇 2,2二甲基-3-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第n周期的最后一种金属元素处在第n主族(n>1) | |
| B. | m=1与m=7的元素单质相互化合时,都能形成离子化合物 | |
| C. | 第n周期有8-n种非金属元素(n>1,包括稀有气体元素) | |
| D. | m-n=5的主族元素存在本周期最强的对应含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量碳酸钙固体放在广口瓶中 | |
| B. | 少量浓硝酸放在棕色细口瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
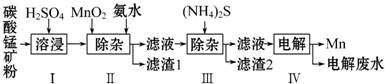
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 |
| 物质 | MnS | CoS | NiS |
| Ksp | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com