
����Ŀ����1����̬ͭԭ�ӵĺ���δ�ɶԵ�����ĿΪ___________��
��2�����ݵ�2����Ԫ�ص�һ�����ܵı仯���ɣ�������ͼB��FԪ�ص�λ�ã���С�ڵ���C��N��O����Ԫ�ص����λ�á�

��3��NF3����NH3��F2��Cu���������·�Ӧֱ�ӵõ���
2NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
������ѧ����ʽ�е�5�����������ľ���������___________��
��4��BF3��һ����ˮ�γɣ�H2O��2BF3����Q��Q��һ�������¿�ת��ΪR:
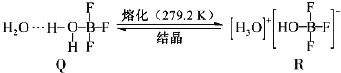
������Q�и��������ǿ�����������___________������ţ���
a�����Ӽ� b�����ۼ� c����λ�� d�������� e����� f�����»���
��R�������ӵĿռ乹��Ϊ___________�������ӵ�����ԭ�ӹ������1��2sԭ�ӹ����___________��___________ԭ�ӹ���ӻ���
��5����ͭ�ۼ���Ũ��ˮ��.��ͨ����������ַ�Ӧ����Һ�����ɫ��һ��ͭ���ӵ���λ�����.
�÷�Ӧ�����ӷ���ʽΪ___________��
��6��������Ϊ�������������ṹ�����ͣ�.�����е���λ��Ϊ___________����������ܶ�Ϊ��g/cm3����ԭ�Ӱ뾶Ϊ___________cm���ú�����NA�Ĵ���ʽ��ʾ�����ػ���
���𰸡���1��1��
��2��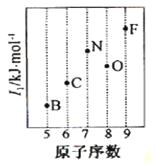
��3�����Ӿ��塢���Ӿ��塢��������
��4����bc�� ��������3��2p
��5��2Cu+8 NH3H2O+O2=2[Cu��NH3��4]2++4OH-+6H2O
��6��8��![]() ��
��![]()
�������������������1��Cuԭ�Ӻ�����29�����ӣ���̬ͭԭ�ӵĺ�������Ų�ʽΪ��1s22s22p63s23p63d104s1��δ�ɶԵ�����ĿΪ1�ʴ�Ϊ��1��
��2��ͬ�����������Ԫ�صĵ�һ�����ܳ��������ƣ�����Ԫ�ص�2p�ܼ�����3�����ӣ����ڰ����ȶ�״̬���������ͣ���Ԫ�صĵ�һ�����ܸ���ͬ��������Ԫ�أ���C��N��O����Ԫ�ص����λ��Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3��Cu�ǽ��������ڽ������壬NH4F���Σ��������Ӿ��壬NH3��F2��NF3�����ڷ��Ӿ��壬�ʴ�Ϊ�����Ӿ��塢���Ӿ��塢�������壻
��4������Q�Ľṹ��֪��Q�����д�������������ۼ�����λ����O��B֮�䣩�����Ӽ�������������ǿ����������й��ۼ�����λ�����ʴ�Ϊ��bc��
��R��������ΪH3O+������ԭ����ԭ�Ӽ۲���Ӷ���=3+![]() ����61��31��=4���µ��Ӷ�=
����61��31��=4���µ��Ӷ�=![]() ����61��31��=1��Ϊ�����ͣ������ӵ�����ԭ��Oԭ�Ӳ���1��2sԭ�ӹ����3��2pԭ�ӹ���ӻ����ʴ�Ϊ�������Σ�3��2p��
����61��31��=1��Ϊ�����ͣ������ӵ�����ԭ��Oԭ�Ӳ���1��2sԭ�ӹ����3��2pԭ�ӹ���ӻ����ʴ�Ϊ�������Σ�3��2p��
��5����Cu���ʵķ�ĩ����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ������[Cu��NH3��4]2+���÷�Ӧ�����ӷ���ʽ�ǣ�2Cu+8 NH3H2O+O2=2[Cu��NH3��4]2++4OH-+6H2O���ʴ�Ϊ��2Cu+8 NH3H2O+O2=2[Cu��NH3��4]2++4OH-+6H2O��
��6�����Ľ����ܶѻ���ʽΪ���������ṹ����������ԭ�ӵ���λ��Ϊ8������ԭ�Ӱ뾶Ϊrcm�����������к���1+8��![]() =2����ԭ�ӣ���������Խ�����Ϊ������ԭ�����У�����Խ���Ϊ4rcm�������߳�Ϊ��
=2����ԭ�ӣ���������Խ�����Ϊ������ԭ�����У�����Խ���Ϊ4rcm�������߳�Ϊ��![]() rcm���������Ϊ����
rcm���������Ϊ����![]() rcm��3�����Ը�������
rcm��3�����Ը�������![]() =
=![]() =
=![]() �����r=
�����r=![]() ��
��![]() cm���ʴ�Ϊ��8��
cm���ʴ�Ϊ��8��![]() ��
��![]() ��
��


 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��X(g)+2Y(g)![]() 2Z(g)��2M(g)
2Z(g)��2M(g)![]() N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܱո��塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ���������෴Ӧ���¶���ͬ���������ж���ȷ���ǣ�
N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܱո��塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ���������෴Ӧ���¶���ͬ���������ж���ȷ���ǣ�

A����Ӧ�ٵ�����Ӧ�����ȷ�Ӧ
B����ƽ�⣨I��ʱ��ϵ��ѹǿ�뷴Ӧ��ʼʱ��ϵ��ѹǿ֮��Ϊ14:15
C����ƽ�⣨I��ʱX��ת����Ϊ5/11
D����ƽ�⣨I����ƽ�⣨II����M�����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ʳ�������ˮ�еĵ�Ԫ�ض���NH4+��NH3��H2O����ʽ���ڣ��÷�ˮ�Ĵ����������£�

��1��������:��NaOH��Һ�������������ӷ���ʽ��ʾΪ____________������pH��9��������30����ͨ���������ϳ������գ�
��2��������:���������õ������£�NH4+����������Ӧ��������NO3-��������Ӧ�������仯ʾ��ͼ���£�
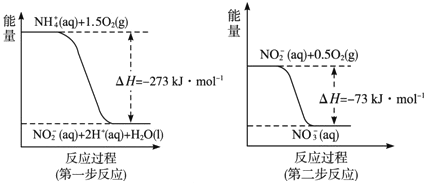
����һ����Ӧ���Ȼ�ѧ����ʽ��____________��
��1molNH4+(aq)ȫ��������NO3-(aq)���Ȼ�ѧ����ʽ��____________��
��3��������:һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32gCH3OHת��6mol���ӣ���÷�Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҹ�������������ŷŵķ�����ʯ����ȡ���Ტ����ˮ��ļ����о���óɹ�����֪��ʯ����Ҫ�ɷ���Ca3��PO4��2�����������������£�

�ش��������⣺
��1��װ��a����������NH3�����ù�����ʵ�����н��У��뻭��װ��a��ʾ��ͼ��___________��
��2���Ƚ�������ʵ�����Ƚ�����װ�ã���ѧʵ����Ҳ���������Ƚ�����ʵ��ij��ʵ��Ŀ�ģ�������Һ�Ƚ���ʱͨ��ʹ�õ�������___________��
��3��������²����A��һ�����е����ʵĻ�ѧʽ��___________���ᾧˮ���ֲ�д����
��4��������������ŷŵķ�����ʯ����ȡ���ᣬ����SO2��������Ĺ�������ͼ��ͼ��ʾ��

����A�������������������������豸A��������___________���豸A�з�����Ӧ�Ļ�ѧ����ʽ��___________��Ϊ�����������IJ��ʣ��ô�Ӧ����___________���������¹������������ȹ�������Ϊ�ˡ�
����D�����ж��δ�������ԭ����___________��
��B������������Ҫ�ǵ�������������ʱ���徭��C����������D����Ϊ��___________��
��20%�ķ���������SO3����������Ϊ20%��1�����ˮ___________��������2λ��Ч�������������Ƴ�98%�ij�Ʒ���ᡣ
��5����������������β�����˺���N2��O2�⣬������SO2������SO3�������������ڲⶨ����β����SO2��������___________��ѡ����ĸ��
A��NaOH��Һ����̪��Һ
B��KMnO4��Һ��ϡH2SO4
C����ˮ��������Һ
D����ˮ����̪��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��FΪ������Ԫ�أ��ǽ���Ԫ��A����������������������ͬ��B����������������������������2����B�ĵ�����D�ĵ����г��ȼ������������ۻ�����BD2��E����D2��������ͬ�ĵ�������A�ĵ�����F�ĵ�����ȼ�հ��в�ɫ���棬��������ˮ�õ�һ��ǿ�ᡣ�ش��������⣺
��1��F��Ԫ�ط���Ϊ___________________________��
��2��A�����ڱ��е�λ���� ��
��3��A��D��Ӧʱ�������γ�ԭ��أ���ԭ��صĸ����Ϸ���������Ӧ��������________��
��4��B��D��E��ɵ�һ�����У�E����������ΪԼ43%��������Ϊ ��
��5��E��D��ȼ�ղ���ĵ���ʽΪ____________________________________��
��6��A��E�����γ����ӻ�����û�������ˮ��Ӧ�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ����������֤��ϩ��������Ӧ�����װ�ã���ش��������⣺

��1��������װ��������ȡ��ϩ�����а�����������ҩƷ�ǣ�
�����Ƭ ��ʯ����������̨ ��Բ����ƿ ���¶ȼƣ�����100�������¶ȼƣ�����200�����ƾ��� �ߵ����� ��˫�����ᵼ�ܡ���ѡ�õ������� �����ţ���
д������ϩ��ѧ����ʽ��_____________________________����Ӧ����һ��ʱ�������װ���л��Һ����ڣ������д̼�����ζ������������������� ����Ҫ��֤�и��������ɣ�Ӧ�����ɵ�����ͨ�� ��Һ��
��2��NaOH��Һ��������___________________����ʯ�ҵ������ǣ�_____________________��
��3��ʵ������У�������ˮ����ɫ�����ܵ�ԭ���ǣ�________ _____��
��4������ʲô�����˵�����������飿_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�Ӻ�������Ų�ʱ��������K��L��M����ʾ��һ�㡢�ڶ��㡢�����㣻AԪ��ԭ��M���Ӳ�����3�����ӣ�BԪ����AԪ�ص�ԭ�Ӻ�����Ӳ�����ͬ��BԪ�ص�ԭ������������Ϊ1��CԪ�ص�ԭ�ӱ�BԪ��ԭ����4�����ӡ�
��1��BԪ�ص�ԭ�ӽṹʾ��ͼΪ ��
��2��AԪ�������ڱ��е�λ�� ��
��3������BԪ�صĻ���������ɫ����������ʱ����� ɫ��
��4��A��B������������ˮ�������Ӧ�����ӷ���ʽΪ�� ��
��5��CԪ�ص��������ж��֣�������ɫΪ����ɫ�������������������ѧʽ��
��6��A��B��ȣ�A�Ľ�������������B�Ľ����ԣ�����ǿ����������������
��7��A�ĵ���������������������NaOH��Һ��Ӧ����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NO2��N2O4�ת����2NO2��g��![]() N2O4��g������H=��24.2kJ/mol���ں����£���һ����NO2��N2O4��g���Ļ������������Ϊ2L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ���������������������ǣ� ��
N2O4��g������H=��24.2kJ/mol���ں����£���һ����NO2��N2O4��g���Ļ������������Ϊ2L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ���������������������ǣ� ��
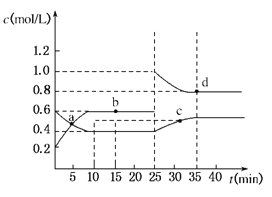
A��a��b��c��d�ĵ���V����V�������
B����Ӧ���е�10minʱ����ϵ���յ�����Ϊ9.68kJ
C��ǰ10min�ڣ���v��NO2����ʾ�ĸ÷�Ӧ����Ϊ0.02mol/Lmin
D��25minʱ������ƽ���ƶ���ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��![]() ��̼��������Ĺ�ҵ����ԭ������ͼ��Ͷ�ϱ�[
��̼��������Ĺ�ҵ����ԭ������ͼ��Ͷ�ϱ�[![]() ]�ֱ�Ϊ3:1��1:1����Ӧ��������ʵ�����ͬʱ��
]�ֱ�Ϊ3:1��1:1����Ӧ��������ʵ�����ͬʱ��![]() ��ƽ��ת�������¶ȵĹ�ϵ����������˵����ȷ����
��ƽ��ת�������¶ȵĹ�ϵ����������˵����ȷ����
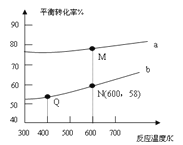
A������b����Ӧ��Ͷ�ϱ�Ϊ3:1
B��M���Ӧ��ƽ�ⳣ��С��Q��
C��N���Ӧ��ƽ��������̼������������ʵ�������Ϊ0.58
D��M���Q���Ӧ��ƽ��������������ʵ���֮��Ϊ2:1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com