
| A. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$amol | |
| B. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$ | |
| C. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤amol |
分析 Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,当n(KOH)=amol时,由K原子守恒可知,a=n(KCl)+(KClO)+n(KClO3),由电子守恒可知,n(KCl)=(KClO)+n(KClO3)×5,由产物的组成可知n(K)=n(Cl),以此来解答.
解答 解:A.不生成KClO时KClO3的理论产量最大,由电子守恒可知,n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,故A错误;
B.若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,令n(ClO-)=1mol,反应后c(Cl-):c(ClO-)=11,则n(Cl-)=11mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×11mol,解得n(ClO3-)=2mol,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$,故B正确;
C.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量等于$\frac{1}{2}$amol,故C正确;
D.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,转移电子最大物质的量=$\frac{1}{6}$a mol×5=$\frac{5}{6}$a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),由钾离子守恒:n(KCl)+n(KClO)=n(KOH),故n(KClO)=$\frac{1}{2}$n(KOH)=$\frac{1}{2}$amol,转移电子最小物质的量=$\frac{1}{2}$amol×1=$\frac{1}{2}$amol,故反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol,故D错误;
故选AD.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子及原子守恒为解答的关键,侧重分析与计算能力的考查,选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
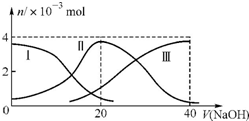 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )| A. | 曲线Ⅱ代表的粒子是HC2O4- | |
| B. | 当V(NaOH)=20ml时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | NaH C2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| D. | 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液PH可能逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )(自行选择无机原料),请书写化学反应方程式:
)(自行选择无机原料),请书写化学反应方程式: ,nCH2=CHCl$\stackrel{催化剂}{→}$
,nCH2=CHCl$\stackrel{催化剂}{→}$ ;
;  .其反应类型为消去反应.检验生成的乙烯要将导管先后通入NaOH溶液、酸性KMnO4溶液或溴水.(填试剂名称)
.其反应类型为消去反应.检验生成的乙烯要将导管先后通入NaOH溶液、酸性KMnO4溶液或溴水.(填试剂名称) ,
, ;
;  能发生反应生成一种含五元环的化合物,请书写化学反应方程式
能发生反应生成一种含五元环的化合物,请书写化学反应方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的化学性质不活泼 | |
| B. | 铝制容器既耐酸又耐碱 | |
| C. | 铝与氧气在常温下不反应 | |
| D. | 铝易被氧化,但氧化生成的氧化铝具有保护内层金属铝的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀溶液的pH,测定值可能偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1LO2 | B. | 0.25LO2 | C. | 0.25LNO | D. | 0.5LO2和1LNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com