
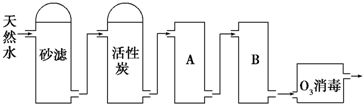
分析 由工艺流程示意图可知,天然水$\stackrel{沙滤}{→}$去除水中不溶性杂质$\stackrel{活性炭}{→}$通过吸附作用去除有毒、有异味的分子$\stackrel{阳离子交换树脂}{→}$去除水中的阳离子$\stackrel{阴离子交换树脂}{→}$去除水中的阴离子$\stackrel{O_{3}}{→}$杀菌消毒,以此来解答.
解答 解:由工艺流程示意图可知,天然水$\stackrel{沙滤}{→}$去除水中不溶性杂质$\stackrel{活性炭}{→}$通过吸附作用去除有毒、有异味的分子$\stackrel{阳离子交换树脂}{→}$去除水中的阳离子$\stackrel{阴离子交换树脂}{→}$去除水中的阴离子$\stackrel{O_{3}}{→}$杀菌消毒,
①活性炭具有吸附性,则活性炭的作用是吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物无毒无害,
故答案为:吸附水中的有机物(或去除水中的异味);反应产物无毒无害;
②由上述分析可知,A为阳离子交换树脂,B为阴离子交换树脂,若A为阴离子交换树脂易导致钙离子转化为沉淀堵塞,故答案为:阳离子交换树脂;阴离子交换树脂.
点评 本题以信息形式考查污水处理及自来水净化,为高频考点,明确发生的反应及净化流程为解答的关键,注重化学与生活的联系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如下图),下列有关说法正确的是( )
正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如下图),下列有关说法正确的是( )| A. | 正硼酸晶体属于原子晶体 | |
| B. | H3BO3分子的稳定性与氢键有关 | |
| C. | 分子中硼原子最外层满足8电子稳定结构 | |
| D. | 1 mol H3BO3晶体中有3 mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (3) | ||
| (2) | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 因为酸性HCl>H2S,判断硫、氯的非金属性强弱 | |
| C. | 稳定性CH4<SiH4,判断硅与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com