
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
分析 已知 X、Y、Z、M、R五种元素中,原子序数X<Y<Z<M<R,
X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;
Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;
Z元素在元素周期表的各元素中电负性仅小于氟,则Z为O元素;
M元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则M为Cl;
第四周期过渡元素,其价电子层各能级处于半充满状态,应为Cr元素,价层电子排布式为3d54s1,以此解答该题.
解答 解:已知 X、Y、Z、M、R五种元素中,原子序数X<Y<Z<M<R,
X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;
Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;
Z元素在元素周期表的各元素中电负性仅小于氟,则Z为O元素;
M元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则M为Cl;
第四周期过渡元素,其价电子层各能级处于半充满状态,应为Cr元素,价层电子排布式为3d54s1,
(1)M为Cl,原子核外电子排布为1s22s22p63s23p5共有17种不同运动状态的电子,有5种不同能级的电子,
故答案为:17;5;
(2)由于N原子的2p能级电子为半充满,为较稳定的结构,则N的第一电能较大,故答案为:N;N原子的2p能级电子为半充满,为较稳定的结构;
(3)Cr的最高化合价为+6,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,则CrCl3•6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3•6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2•H2O,
故答案为:B.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电负性、配合物、元素化合物性质等知识,为高考常见题型,难度中等,明确元素种类是关键,(3)中注意配合物中外界离子与配体性质区别.


科目:高中化学 来源: 题型:选择题
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
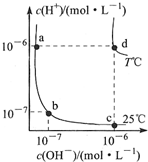
| A. | d点对应的食盐水pH=6,呈中性 | |
| B. | 向a点对应的醋酸溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-) | |
| C. | T℃时,0.05mol/LBa(OH)2溶液的pH=11 | |
| D. | a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
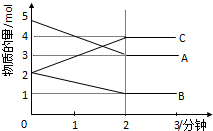 某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:
某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com