
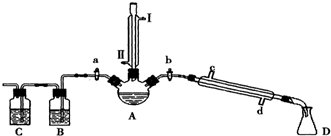
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
分析 (1)采取逆流原理通入冷凝水,以保证水充满冷凝管,起到充分冷凝的作用;有机物易挥发,冷凝管起冷凝回流作用;
(2)由(3)中物质沸点可知,反应生成的1-丁烯、溴化氢及水蒸气会进入B、C中,装置B、C可以检验1-丁烯、溴化氢的存在,先用石蕊试液或硝酸银溶液检验HBr的存在,再选择试剂溴水或高锰酸钾溶液检验1-丁烯;
(3)利用蒸馏法分离出1-溴丁烷,具体操作为:待烧瓶冷却后,拔去竖直的冷凝管,插上带橡皮塞的温度计,关闭活塞a,打开活塞b,接通冷凝管的冷凝水,使冷水从d处流入,迅速升高温度至101.6℃,收集所得馏分;
(4)进行过量计算,根据不足量物质计算1-溴丁烷的理论产量,其产率=(实际产量÷理论产量)×100%.
解答 解:(1)采取逆流原理通入冷凝水,以保证水充满冷凝管,起到充分冷凝的作用,即竖直冷凝管冷凝水流从下口Ⅱ进,从上口Ⅰ流出;
有机物易挥发,冷凝管起冷凝回流作用,充分利用原料,
故答案为:Ⅱ;冷凝回流;
(2)由(3)中物质沸点可知,反应生成的1-丁烯、溴化氢及水蒸气会进入B、C中,装置B、C可以检验1-丁烯、溴化氢的存在,先用石蕊试液或硝酸银溶液检验HBr的存在,再选择试剂溴水或高锰酸钾溶液检验1-丁烯,与溴水反应方程式为:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3,
故答案为:溴化氢;CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3;
(3)利用蒸馏法分离出1-溴丁烷,具体操作为:待烧瓶冷却后,拔去竖直的冷凝管,插上带橡皮塞的温度计,关闭活塞a,打开活塞b,接通冷凝管的冷凝水,使冷水从a处流入,迅速升高温度至101.6℃,收集所得馏分,
故答案为:③a,b;④d处; ⑤101.6℃;
(4)7.4g 1-丁醇完全反应需要NaBr的质量为$\frac{7.4g}{74g/mol}$×103g/mol=10.3g<13g,故丁醇不足,则理论上得到1-溴丁烷质量为$\frac{7.4g}{74g/mol}$×137g/mol=13.7g,实际得到9.6g 1-溴丁烷,故其产率=(9.6g÷13.7)=0.70,
故答案为:0.70.
点评 本题有机物的实验制备方案、物质的检验、混合物分离提纯、产率计算等,明确原理是解题关键,题目难度中等.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )
四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )| A. | 1molW的单质在足量空气中燃烧转移电子数是6NA | |
| B. | 含Y元素的盐溶液可能显酸性,也可能显碱性 | |
| C. | Z元素的单质和氧化物不能与任何酸发生反应 | |
| D. | X与H、O元素形成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl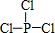 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

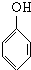 +nHCHO$\stackrel{催化剂}{→}$
+nHCHO$\stackrel{催化剂}{→}$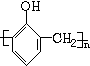 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com